Grasso viscerale e diabete tipo 2
Come riportato da Bastard JP dell’Université Pierre et Marie Curie, Paris e collaboratori, al momento attuale le evidenze avrebbero dimostrato che nella maggior parte dei pazienti obesi si associa un basso grado d’infiammazione del tessuto adiposo bianco (WAT), risultante dall’attivazione cronica del sistema immunitario (Eur Cytokine Netw. 2006; 17(1):4-12). Tale condizione può aprire il varco alla successiva resistenza insulinica, all’alterata tolleranza al glucosio, fino al diabete. Il WAT è il sito fisiologico d’immagazzinamento dell’energia in forma di grassi. Inoltre, è stato più recentemente riconosciuto come un partecipante attivo a numerosi processi fisiologici e fisiopatologici. Nell’obeso il WAT è caratterizzato da un aumento della produzione e secrezione di una vasta gamma di molecole infiammatorie tra cui il TNF-α (Tumour Necrosis Factor-alpha) e l’IL-6 (interleukin-6), che possono avere effetti locali sulla fisiologia dello stesso WAT, ma anche effetti sistemici su altri organi. Dati recenti indicano che il WAT degli obesi è infiltrato da macrofagi che possono essere una delle principali fonti di produzione locale delle citochine pro-infiammatorie. Curiosamente la perdita di peso si associa a una riduzione dell’infiltrazione dei macrofagi nel WAT e a un miglioramento del profilo di espressione genica infiammatoria. Diversi fattori, derivati non solo dagli adipociti ma anche dai macrofagi infiltrati, contribuiscono probabilmente alla patogenesi dell’insulino-resistenza. La maggior parte di essi sono prodotti in eccesso durante l'obesità, tra cui la leptina, il TNF-α, l’IL-6 e la resistina. Al contrario, il livello di espressione dell’adiponectina plasmatica, un effettore insulinosensibilizzante, è sottoregolato durante l'obesità. La leptina potrebbe modulare la produzione del TNF-α e l'attivazione dei macrofagi. Il TNF-α è iperprodotto nel tessuto adiposo nei diversi modelli dei roditori obesi e riveste un importante ruolo nella patogenesi dell’insulino-resistenza in queste specie. Tuttavia, il suo effettivo coinvolgimento nei disordini del metabolismo del glucosio degli esseri umani rimane ancora controverso. L’IL-6 del tessuto adiposo umano aumenta durante l'obesità. Si può indurre la sintesi epatica del CRP e favorire l'insorgenza delle complicanze cardiovascolari. Sia il TNF-α sia l’IL-6 possono alterare la sensibilità all'insulina, attivando i diversi passaggi chiave della via di segnalazione dell'insulina. Nei roditori la resistina può indurre insulino-resistenza, mentre la sua implicazione nel controllo della sensibilità all'insulina è ancora negli esseri umani oggetto di dibattito. L'adiponectina è altamente espressa nel WAT e i suoi livelli circolanti sono diminuiti nei soggetti con obesità-correlata all’insulino-resistenza, al diabete di tipo 2 e alla malattia coronarica. Da notare che l'adiponectina inibisce la neoglucogenesi epatica e promuove l'ossidazione degli acidi grassi nel muscolo scheletrico. Inoltre, essa neutralizza gli effetti pro-infiammatori del TNF-α sulla parete arteriosa e protegge probabilmente contro lo sviluppo dell’arteriosclerosi. Nell’obesità gli effetti pro-infiammatori delle citochine coinvolgono, attraverso le vie di segnalazione intracellulari, i sistemi dello NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells) e dello JNK (c-Jun NH2-terminal kinase). In differenti modelli animali sperimentali le manipolazioni genetiche o farmacologiche di questi effettori della risposta infiammatoria hanno dimostrato di modulare la sensibilità all'insulina. Negli esseri umani si è ipotizzato che il miglioramento osservato della tolleranza al glucosio alla presenza dei tiazolidinedioni o statine possa essere probabilmente correlato alle loro proprietà antinfiammatorie. Pertanto, si può ritenere che l'obesità corrisponde a una condizione sub-clinica infiammatoria, favorente la produzione dei fattori pro-infiammatori coinvolti nella patogenesi dell’insulino-resistenza.
Ian J. Neeland dell’University of Texas Southwestern Medical Center in Dallas e collaboratori hanno voluto esaminare in una coorte multietnica di adulti obesi le associazioni tra i vari fenotipi dell’adiposità e il rischio del prediabete e diabete (JAMA. 2012;308(11):1150-1159). Ciò in ragione dell’eterogeneità riscontrata sul rischio di diabete mellito di tipo 2 negli obesi e in ordine anche alla non chiara caratterizzazione dei fattori che discriminano il rischio di prediabete o di diabete all'interno di questa popolazione. Hanno, così, arruolato tra il 2000 e il 2002 dal Dallas Heart Study 732 obesi con indice di massa corporea ≥ 30 di età compresa tra i trenta e i sessantacinque anni, di età media di quarantatré, nel 65% donne e nel 71% non bianchi, senza diabete o malattie cardiovascolari. Hanno misurato la DXA / DEXA (Dual Energy X-Ray Absorptiometry), la MRI (magnetic resonance imaging), i biomarcatori dell’insulino-resistenza, le adipochine circolanti, la lipidemia, gli indici dell'infiammazione e dell’aterosclerosi subclinica, la struttura e la funzione cardiaca con la tomografia computerizzata e la risonanza magnetica. Attraverso una media di follow-up di sette anni (range interquartile, 6,6-7,6), hanno determinato in un sottogruppo di 512 partecipanti con normali valori di glicemia a digiuno al basale l'incidenza del composito di prediabete o diabete.
Dei 732 partecipanti 84, pari all’11,5%, sviluppavano il diabete, quarantacinque dei quali, pari al 53,6%, avevano al basale un’alterata glicemia a digiuno (IFG), di cui dodici, pari al 14,3%, con diagnosi secondo criteri della sola HbA1c. All'analisi multivariata la massa di grasso viscerale superiore al riferimento (odds ratio [OR] per un DS [1,4 kg], 2,4, IC 95%, 1,6-3,7), il livello di fruttosamina (OR per un DS [1.1 mmol / l], 2.0; IC 95%, 1,4-2,7), il livello di glicemia a digiuno (OR per 1 DS [1.1 mmol / l], 1,9, IC 95%, 1,4-2,6), la storia familiare di diabete (OR 2,3, IC 95%, 1.3- 4.3), la pressione arteriosa sistolica (OR per 10 mm Hg di aumento, 1.3, IC 95%, 1,1-1,5) e l’aumento di peso al follow-up (OR per 1 kg, 1,06, IC 95%, 1,02-1,10) erano indipendentemente associati con il diabete. Non si osservavano correlazioni, invece, per l'indice di massa corporea, il grasso corporeo totale o per il grasso addominale sottocutaneo. Tra i 512 partecipanti con valori normali di glucosio al basale, l'esito composito del prediabete o del diabete si verificava nel 39,1%, in modo indipendente alle misurazioni della massa viscerale grassa, dei livelli di glicemia a digiuno, dell’insulina, della fruttosamina, dell'età più avanzata, della razza non bianca, della storia familiare di diabete e dell'aumento del peso nel follow-up (p <.05 per ciascuno), ma non con le misure dell’adiposità generale. Comunque, la probabilità di sviluppare in seguito il diabete era maggiore in coloro che all’inizio avevano l’IFG, una storia familiare di diabete, l’ipertensione, la sindrome metabolica con un modello di omeostasi più elevato di valutazione dell’insulino-resistenza (HOMA-IR), i livelli più elevati di fruttosamina e di trigliceridi, una maggiore concentrazione di particelle lipoproteiche di grandi dimensioni a molto bassa densità. Si dimostrava anche un’associazione inversa tra la massa corporea con il basso tenore di grassi, i livelli di adiponectina da una parte e le concentrazioni delle grandi lipoproteine ad alta densità, le particelle delle lipoproteine a bassa densità e l’incidente di diabete dall’altra.
La stratificazione per i marcatori di resistenza all’insulina rivelava che la massa grassa viscerale era, inoltre, associata all’incidente di diabete sia con l’HOMA-IR sia con il livello di fruttosamina. Altri fattori, a tale proposito, erano la circonferenza vita di base, il rapporto vita-fianchi e la percentuale di grasso del fegato, Invece, i marcatori dell’adiposità generale, compresa la BMI, la massa grassa del tronco e il livello proteina C-reattiva ad alta sensibilità erano esclusi da questa correlazione.
In conclusione l’eccesso di grasso viscerale e l’insulino-resistenza, ma non l’adiposità generale, erano indipendentemente associati all’incidente di prediabete e di diabete mellito di tipo 2 negli adulti obesi. Tale dato suggeriva che un fenotipo di adiposità disfunzionale, caratterizzato da un eccesso di grasso viscerale e dall’insulino-resistenza, potesse contribuire allo sviluppo del diabete nei soggetti con obesità.
A tale proposito, considerando le evidenze sull’associazione tra l’adiposità e i bassi livelli della vit. “D” (vedi notiziario di ottobre 2012 N ° 9) è utile considerare lo studio di E. D. Gorham dell’University of California San Diego e collaboratori i quali, ipotizzando che i bassi livelli sierici della vitamina potessero aumentare il rischio di maggiore richiesta d’insulina nei pazienti, hanno svolto uno studio caso-controllo durante il periodo 2002-2008 in membri del servizio militare (Diabetologia (2012) 55:3224–3227). L’OR della richiesta insulinica per il quintile dei livelli sierici di 25 (OH) D, dal più basso al più alto, era 3,5 (IC 95% 2.0, 6.0), 2.5 (1.5, 4.2), 0.8 (0.4, 1.4), 1.1 (0.6, 2.8) e 1.0 come riferimento (P <0,001). I quintili, basati sui quinti della concentrazione della 25 (OH) D nel siero dei controlli erano, invece, <43 (media 28), 43-59 (media 52), 60-77 (media 70), 78-99 (media 88) e ≥ 100 (media 128).
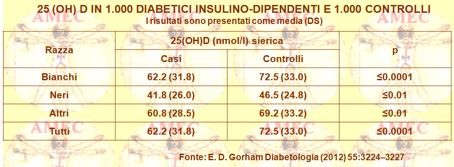
In conclusione, gli individui con bassa 25 (OH) D sierica avevano un più alto rischio di diabete con richiesta insulinica, rispetto a quelli con le concentrazioni vitaminiche più elevate. Per un rischio di 3,5 volte più basso si associava una concentrazione sierica di 25 (OH) D ≥ 60 nmol / l.











.png)





