Tessuto adiposo disfunzionale, adipochine, RAAS, SNS e ipertensione
D’altro canto, il sovrappeso e l’obesità sono caratterizzati dalla presenza di un tessuto adiposo non inerte ma disfunzionale, composto di adipociti, macrofagi, fibroblasti e cellule endoteliali che producono una vasta gamma di ormoni e citochine. Tra queste ultime, comunemente denominate adipochine o adipocitochine, la più nota è la leptina, coinvolta nella regolazione dell'appetito, del metabolismo basale e della fertilità. Inoltre, altre sostanze coprono un ruolo nel metabolismo del glucosio e dei lipidi, come l’adiponectina, esclusivamente secreta dal tessuto adiposo, e la CETP (cholesteryl ester transfer protein), nell’infiammazione, come il TNF-α [tumor necrosis factor-alpha] e l’IL-6 [interleuchina-6] e nella coagulazione, come il PAI-1 (Plasminogen activator inhibitor-1). Inoltre, il tessuto adiposo normalmente funzionante produce anche le componenti del RAAS (renin angiotensin aldosterone systems), come l’AGT (angiotensinogen) e l’ACE (angiotensin-converting enzyme). In realtà il tessuto adiposo disfunzionale dell'obeso è caratterizzato microscopicamente da adipociti ipertrofici con aumento dell’infiltrazione dei macrofagi e con marcati cambiamenti funzionali della secrezione delle adipochine e degli acidi grassi liberi saturi. Il rilascio della maggior parte delle adipochine, tra cui la leptina, il TNF-α e l’IL-6, è elevata, mentre la produzione dell’adiponectina è soppressa. Ne derivano importanti conseguenze metaboliche con aumento dell’insulino-resistenza per diminuzione dei livelli dell’adiponectina, poiché i suoi recettori epatici e muscolari non riescono a mediare la β-ossidazione degli acidi grassi, l’assorbimento del glucosio, la gluconeogenesi e l’attivazione del PPAR (peroxisome proliferatoractivated receptor-g). In particolare, la riduzione della produzione dell’adiponectina da parte del tessuto adiposo disfunzionale
può anche fornire un collegamento diretto tra l’obesità e l’ipertensione. Difatti, l'adiponectina determina un importante stimolo sull’eNOS (endothelial nitric oxide synthase), giocando un ruolo critico nel controllo del tono vascolare, dell’infiammazione e della proliferazione delle cellule muscolari lisce. Nell’uomo, in effetti, i livelli dell’adiponectina sono indipendentemente correlati alla disfunzione vasomotoria e, quindi, alla resistenza vascolare periferica.
Peraltro, oltre ai diminuiti livelli dell’adiponectina, l’elevata concentrazione degli acidi grassi liberi e del TNF-α, determinati dal tessuto adiposo disfunzionale, può anche fornire un potenziale diretto per la disfunzione
endoteliale. Difatti, entrambi questi elementi mettono in pericolo la fosforilazione dell’eNOS in risposta all'insulina, secondo un’azione attribuita all’inibizione della fosforilazione della tirosina da parte dell’IRS-1 (Insulin receptor substrate 1). Gli effetti della vasodilatazione da insulina, che normalmente determinano il maggiore flusso sanguigno muscolare scheletrico, sono, quindi, aboliti dagli elevati livelli degli acidi grassi liberi e del TNF-α, causando negli obesi la ridotta reattività endoteliale.
Sotto altro fronte, sono ancora incerte le conseguenze dell’elevato tasso di resistina nel sangue. Questa sostanza, scoperta solo nel 2001, deriva il suo nome proprio per la riconosciuta resistenza all'insulina osservata nei topi in cui era iniettata. Fu, quindi, riconosciuta come un prodotto rilasciato dal tessuto adiposo con funzione vera e propria endocrina nel complesso sistema della resistenza all'insulina. Peraltro, in seguito a ulteriori ricerche, la resistina è stata collegata ad altri sistemi fisiologici, come l'infiammazione e l'omeostasi energetica. Svolge, comunque, un ruolo fisiologico ancor oggi oggetto di molte controversie nell’ambito dell'obesità e del diabete mellito di tipo 2. È nota anche come ADSF (adipose tissue-specific secretory factor) ed è una proteina ricca di cisteina codificata nell'uomo dal gene RETN. Provoca alti livelli di LDL, aumentando, così, il rischio delle malattie cardiovascolari. In vitro danneggia la funzione endoteliale, diminuendo l’espressione dell’eNOS e favorendo il rilascio dall'endotelio del potente vasocostrittore endotelina-1. Mentre nei topi la sua elevata secrezione dagli adipociti provoca resistenza all'insulina con ipertensione, nell’uomo obeso, la resistina, secreta prevalentemente dai macrofagi del tessuto adiposo, raggiunge livelli elevati senza, però, che si sia stata sino a ora dimostrata chiaramente la sua associazione con la pressione sanguigna.
L’attivazione dei RAAS (renin–angiotensin–aldosterone system) costituisce un altro meccanismo chiave nella patogenesi dell'ipertensione correlata all’obesità. La principale sostanza è l’angiotensina II, potente vasocostrittore che aumenta il riassorbimento renale del sodio e che provoca l’ipertrofia vascolare. Promuove anche il rilascio dell’aldosterone dalla corteccia surrenale con effetto aggiuntivo sul riassorbimento renale del sodio. L’obeso presenta generalmente livelli sierici elevati di quasi tutti i componenti del RAAS, che si riducono, a loro volta, durante la perdita di peso.
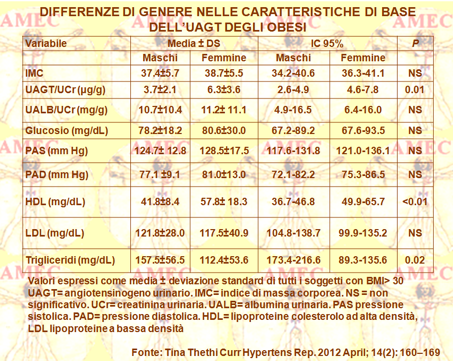
Tina Thethi della Tulane University New Orleans e collaboratori, sulla base del rischio di diabete di tipo 2 (DM), determinato dall'obesità, ma anche per la sua associazione alla malattia renale cronica, in ragione dell’attivazione del sistema RAAS e della stimolazione simpatica, della sintesi delle adipochine e delle alterazioni emodinamiche, hanno dimostrato che gli steroidi sessuali possono modulare l'espressione e l'attività delle varie componenti del RAAS intrarenale e di altri tessuti (Curr Hypertens Rep. 2012 April; 14(2): 160–169). I dati ottenuti suggerivano che le donne obese, senza diabete mellito e ipertensione, avevano livelli significativamente più elevati di UAGT (Urinary Angiotensinogen), indice specifico del RAAS intrarenale, rispetto ai corrispondenti maschi. Queste diversità esistevano, senza alcuna differenza di fondo, nel rapporto tra microalbumina e creatinina urinarie o nel tasso stimato della filtrazione glomerulare. Tale dato sollevava, in effetti, la questione circa l'importanza delle differenze di genere rispetto al basale del RAAS endogeno nello spettro clinico delle malattie cardiovascolari e circa l'utilità potenziale dell’UAGT come marcatore del RAAS intrarenale. Studi sperimentali su animali avevano dimostrato, peraltro, che modificando la quantità dell’angiotensina, componente biologicamente attivo del RAAS, si potesse influenzare direttamente il peso corporeo e l'adiposità.
In via collaterale al ruolo del RAAS per il determinismo dell’ipertensione nell’obesità, bisogna anche considerare quello a lungo termine dello SNS (sistema nervoso simpatico). Difatti, la malattia induce l’attivazione simpatica che può contribuire all’elevazione della pressione sanguigna, mentre la perdita di peso la riduce. Il simpatico, in effetti, causa, di per sé, vasocostrizione periferica e ridotta natriuresi. Inoltre, stimola, da parte delle cellule juxtaglomerulare del rene, il rilascio della renina, induttore importante dell'attività RAAS. Tale effetto sembrerebbe più pronunciato nell’obesità centrale e maggiormente negli uomini, rispetto alle donne.
In tale contesto, un importante ruolo è stato riconosciuto anche alla leptina, dal greco λεπτός = magro, prodotta dagli adipociti in proporzione alle riserve di grasso, la quale agisce principalmente sull’ipotalamo.
Zhang Y e collaboratori (Nature 1994, 372 (6505): 425–432), in base alla clonazione del gene ob, ne definirono la struttura come una proteina di 167-aminoacidi. Quest’ormone è espresso principalmente dagli adipociti e rilasciato nel sangue in proporzione alla dimensione del tessuto adiposo, secondo un segnale coerente alle riserve energetiche. Difatti, la sua espressione genica e la sua secrezione aumentano con la sovralimentazione, la dieta ricca di grassi, l’insulina, i glucocorticoidi, le endotossine e le citochine, mentre diminuiscono con il digiuno, il testosterone, l’ormone tiroideo e l'esposizione al freddo. Nei soggetti magri la leptina circola nel sangue, in forma libera o legata alle proteine, ai livelli bassi di 5-15 ng / ml. In particolare, si è dimostrato che il sistema nervoso simpatico modula l’espressione genica della leptina, per cui il blocco della sintesi di noradrenalina, con alfa-metil-para-tirosina o con simpaticectomia farmacologica con 6-idrossidopamina, aumenta il mRNA leptina e la leptina plasmatica. Queste osservazioni suggeriscono, in effetti, che il sistema nervoso simpatico inibisce tonicamente l’espressione del gene della leptina attraverso un anello di retroazione negativa con il tessuto adiposo. Peraltro, diffondendo la leptina attraverso la barriera ematoencefalica, le sue concentrazioni nel liquido cerebrospinale correlano strettamente in entrambi i sessi con i livelli sierici. In tal modo, gli effetti centrali della leptina includono la riduzione dell'appetito, con ridotta assunzione degli alimenti, e un aumento del tono simpatico tessutale, con crescita della spesa energetica. Alcune evidenze suggeriscono, peraltro, che la leptina può essere prodotta nel cervello. La sua azione nel SNC è di promuove la perdita di peso, diminuendo l'assunzione del cibo e aumentando la spesa energetica.
Coerentemente con il proprio ruolo nella regolazione della spesa energetica, si è dimostrata la sua azione nell’accrescere il turnover della noradrenalina nel tessuto adiposo bruno. Questi dati, insieme a numerosi studi collaterali, hanno supportato fortemente l’affermazione che la leptina attraverso il sistema nervoso simpatico influenza nell'uomo il dispendio energetico.
L'obesità è associata a elevata circolazione dei livelli di leptina, ma a ridotta risposta agli effetti anoressici. Il dato, di fatto, riflette una resistenza all’ormone. In queste circostanze, quindi, si deve postulare che la leptina possa avere un ruolo nel determinismo dell’ipertensione nell'obesità in ragione di una forma di resistenza selettiva, ma con conservazione della reattività simpatica.
La leptina può considerarsi, così, l'ormone dell’obesità, ma si può trovare in eccesso in altre condizioni, quali la sclerosi multipla, il cancro e le malattie cardiache, mentre una sua carenza si ravvede nella malnutrizione e provoca infertilità e immunodeficienza.
L’attivazione del SNA (sympathetic nerve activity), indotta dalla leptina su organi come il rene, ha dato, peraltro, la prima indicazione del suo ruolo potenziale nella regolazione della pressione sanguigna. Difatti, il sistema nervoso simpatico costituisce un componente importante nel controllo della funzionalità renale e la sua stimolazione a lungo termine farebbe aumentare la pressione arteriosa, provocando vasocostrizione e aumentando il riassorbimento tubulare renale del sodio.
L'obesità, come risultato di numerose evidenze, si associa, invero, all'attivazione del sistema nervoso simpatico, tanto che negli obesi le catecolamine plasmatiche e urinarie si ritrovano aumentate. Pur tuttavia, altri meccanismi possono contribuire allo sviluppo dell’ipertensione nell’obesità Studi in vitro, ad esempio, hanno dimostrato che la leptina causa lo stress ossidativo in colture di cellule endoteliali, aumentando la generazione di specie reattive dell'ossigeno. Inoltre, stimola anche la secrezione delle citochine proinfiammatorie, come il fattore di necrosi alfa e l’interleuchina-6, noti per promuovere l'ipertensione. Ancora il sistema della melanocortina sembra mediare l'effetto della leptina sulla pressione sanguigna.
D. Montero dell’University Miguel Hernandez, Elche (Alicante), Spain e collaboratori, di recente hanno proprio ribadito che l'obesità pediatrica è spesso il preludio dell’obesità dell'adulto con comorbidità molto comuni e gravi tanto da stimolare incessantemente la ricerca dei marcatori o dei fattori di rischio per le malattie cardiovascolari (Obesity Reviews Volume 13, Issue 5, pages 441–455, May 2012). In effetti, la disfunzione endoteliale è stata dimostrata nelle fasi iniziali dell’aterosclerosi e può essere valutata con tecniche non invasive, ampiamente accettate e ben standardizzate a livello della macrocircolazione. La disfunzione endoteliale a livello del microcircolo, invece, è meno documentata nei bambini obesi. Comunque, l'obesità pediatrica è stata più volte correlata indipendentemente alla disfunzione endoteliale, all'infiammazione e ai marcatori dello stress ossidativo, anche se la relazione tra questi fattori resta ancora da esplorare. Tuttavia, tutto ciò consentirebbe di raggiungere non solo miglioramenti sostanziali nella stratificazione del rischio, ma anche di fornire dati essenziali circa l'evoluzione della disfunzione endoteliale nell'obesità infantile. In particolare, questa circostanza sarebbe decisiva durante la pubertà, quando si verificano le modifiche pro-infiammatorie e pro-ossidative in relazione con la resistenza insulinica. Le strategie terapeutiche, come gli interventi di stile di vita nell’obesità infantile appaiono, quindi, tanto più necessarie e ottimali con inclusione dell'esercizio e della dieta anche per i loro effetti accertati sui marker dello stress ossidativo e dell’infiammazione, con potenziale reversibilità della disfunzione endoteliale.
Byron Carpenter dell’University of Sheffield e collaboratori hanno di recente definito la struttura di una parte fondamentale del recettore dell’obesità, un fattore essenziale nella regolazione del grasso corporeo. Questa scoperta potrebbe, di fatto, contribuire a fornire nuovi trattamenti per le complicazioni dell’obesità e dell’anoressia (Structure, 2012; 20 (3): 487). Difatti, si potrà migliorare notevolmente la capacità di generare farmaci in grado sia di bloccare sia di stimolare il recettore della leptina, cambiando la vita alle persone che soffrono delle complicazioni dell’obesità e della malnutrizione. I ricercatori hanno risolto la sfida della struttura cristallina del dominio di legame della leptina, relativo al recettore obesità, utilizzando lo stato dell'arte della cristallografia a raggi X, aiutati a capire come bloccare o stimolare il recettore stesso. E, difatti, bloccando il recettore, e, quindi, le azioni eccessive della leptina, si potrebbero prevenire le complicanze dell'obesità, mentre stimolandolo si potrebbe migliorare la fertilità e la risposta immunitaria.











.png)





