NOTIZIARIO Gennaio 2013 N°1
COMPLESSITÀ DELL’OBESITÀ
Struttura e fisiopatologia del tessuto adiposo
A cura di:
Giuseppe Di Lascio §
Susanna Di Lascio***
Con la collaborazione di:
Il tessuto adiposo
L’accezione comune considera il tessuto adiposo soprattutto sede di stoccaggio di energia nell’organismo, prevalentemente sotto forma di trigliceridi. Pur tuttavia, in prima analisi bisogna considerare che, come per gli altri organi e tessuti, l’anatomia e la funzionalità di questo particolare tessuto sono correlate tra loro e che la sua composizione istologica dipende da:
- le caratteristiche individuali, quali ereditarietà, età, razza, sesso, ambiente, bilancio calorico, quantità di cibo ingerito, attività fisica,
- l’origine o sede in fase di analisi,
- le tecniche delle analisi, come l'aspirazione o la biopsia escissionale.
Il tessuto adiposo si trova in molti vertebrati come sofisticato mezzo d’immagazzinamento energetico nell’incertezza del suo approvvigionamento ma non solo, poiché con il tempo gli sono state riconosciute numerose altre funzioni.

Da notare che oggi giorno, da una parte la combinazione di diete insulinogeniche e lo stress psicosociale, e dall’altra la bassa dispersione di energia con lo sforzo fisico, la riproduzione e la funzione immunitaria stimolano la lipogenesi cronica, riducendo la lipolisi. È così che si raggiungono alti livelli di adiposità che diventano tossici e nocivi per la salute.
Peraltro, una delle conseguenze negative della sovralimentazione cronica risiede negli elevati livelli degli acidi grassi liberi, comunemente riscontrati nell’obesità e nel diabete mellito. Questo dato porta, invero, alla diminuita utilizzazione del glucosio, soprattutto a livello del muscolo scheletrico e cardiaco. Inoltre, un aumento dei livelli circolanti degli acidi grassi ha un effetto inibitorio sulla funzione delle cellule β che, così, diminuiscono la secrezione d’insulina. Il tessuto adiposo risponde sia con l’ipertrofia sia con l’iperplasia all'afflusso degli acidi grassi, aumentando il loro stoccaggio in eccesso. Ne deriva un aumento dei tassi d’ipossia e di morte cellulare con una conseguente risposta infiammatoria.
L’aumento dei marcatori dell’infiammazione sembra, oramai, essere uno dei principali motivi con cui s’innesca il complesso meccanismo delle alterazioni metaboliche legate all'obesità. Si sviluppano, così, le comorbidità dell’obesità caratterizzate dall’aumento dell’insulino-resistenza e dell'infiammazione, come il diabete mellito tipo 2, l’ipertensione, l’iperlipidemia, l’apnea ostruttiva del sonno, la steatosi epatica, la sindrome dell'ovaio policistico, le malattie cardiovascolari.
In definitiva, gli acidi grassi liberi come nutrienti rappresentano una fonte importante di energia, ma agiscono in vari processi anche come molecole di segnalazione cellulare. In tale ultimo ambito, sono stati identificati in molte malattie diversi recettori accoppiati alle proteine G. Il GPR120, noto anche come O3FAR1, funziona come un recettore per gli acidi liberi insaturi a catena lunga e ha un ruolo critico in vari meccanismi dell’omeostasi fisiologica, come l’adipogenesi, la regolazione dell'appetito e delle preferenze del cibo. Questa proteina, di fatto, ha sede sulla superficie delle cellule intestinali e degli epatociti, permettendo la rilevazione e la risposta agli acidi grassi insaturi alimentari, soprattutto agli omega-3.
Atsuhiko Ichimura della Kyoto University, Japan e collaboratori hanno dimostrato che i topi carenti di GPR120, alimentati con una dieta ricca di grassi, sviluppavano obesità, intolleranza al glucosio e steatosi epatica, con una diminuzione della differenziazione degli adipociti e con un’avanzata lipogenesi epatica (Nature 483, 350–354, 15 March 2012). Si associavano anche un’insulinoresistenza e una maggiore infiammazione nel tessuto adiposo. I ricercatori hanno analizzato in 6.942 obesi e in 7.654 normopeso di controllo il gene che codifica per la Gpr120. Negli uomini si dimostrava che l’espressione del GPR120 nel tessuto adiposo era significativamente maggiore negli obesi, rispetto ai controlli magri. In altro modo, i soggetti con una certa mutazione nel gene che codifica la GPR120, che comporta l’arresto della risposta della proteina agli acidi grassi omega-3, avevano maggiori probabilità di divenire obesi. La mutazione produceva un effetto simile a quello di una cattiva alimentazione con scarsa componente di acidi grassi omega-3. Inoltre, la variante p.R270H aumentava il rischio dell’obesità nelle popolazioni europee.
Nel complesso, questo studio, a detta degli Autori, dimostrava che il sensore lipidico GPR120 avrebbe un ruolo chiave nel rilevamento dei grassi alimentari e, quindi, nel controllo del bilancio energetico, sia nell'uomo sia nei roditori. Le cause dell’obesità non risiederebbero, quindi nella sola cattiva abitudine alimentare, ma anche nel patrimonio genetico dei malati. Questo studio, che ha visto la partecipazione di Claudio Maffeis e Anita Morandi dell’University of Verona e di Raffaella Buzzetti della Sapienza University di Roma, avrebbe rilevato come il difettoso funzionamento della Gpr 120, proteina con azione di sensore dell’assunzione dei grassi alimentari, possa essere una causa dell’obesità e delle patologie del fegato.
Dieta del paleolitico come promessa di prevenzione e trattamento delle malattie della civiltà
In sintesi, gli spunti precedentemente riportati rivelano gli aspetti socio-ambientali orchestrati collettivamente dal nostro sistema economico capitalista che devono rappresentare l'obiettivo ottimale per la prevenzione dell'obesità.
La capacità di immagazzinare le calorie in eccesso come tessuto adiposo va considerata, peraltro, quell’adattamento opportuno che ha permesso ai nostri antenati di sopravvivere nei vari periodi di scarsezza nutrizionale. Purtroppo, ora l'obesità ha raggiunto proporzioni epidemiche, sia nel mondo sviluppato sia in molti paesi in via di sviluppo.
Kuipers RS dell’University Medical Center Groningen, The Netherlands e collaboratori hanno di recente valutato la composizione e il merito delle cosiddette diete paleolitiche, in conformità a ricostruzioni delle diverse nicchie di ominidi (Nutr Res Rev. 2012 Jun;25(1):96-129). La medicina evoluzionistica riconosce, in effetti, che molte malattie degenerative croniche sono il risultato dei conflitti tra il nostro ambiente in rapida evoluzione con le nostre abitudini alimentari e il nostro genoma, rimasto in pratica invariato dal Paleolitico. Ricostruire i modelli di dieta prima della rivoluzione agricola e industriale è, quindi, opportuno ma s’incontra l’ostacolo del dibattito in corso sulla nicchia ecologica dei nostri antenati. Gli argomenti e le loro controdeduzioni riguardanti la medicina evoluzionistica sono continuamente aggiornati e gli elementi di prova dell'ipotesi a lungo dominante dell'evoluzione umana dall’arida savana vengono controbilanciati da quella che considera l’evoluzione dell'uomo in prossimità dell’acqua. Vi sono evidenze in varie discipline, tra cui lo studio degli ambienti paleolitici, l’anatomia comparata, la biogeochimica, l’archeologia, l’antropologia, fisiopatologia e l’epidemiologia. Anche se i nostri antenati avevano un'aspettativa di vita molto più bassa dell’attuale, i dati attualmente disponibili non supporterebbero l'idea sbagliata che durante il Paleolitico non ci fossero anziani e neanche che questi fossero in cattive condizioni di salute. Invece, piuttosto che rifiutare la possibilità di un sano invecchiamento, l'ipotesi prestabilita dovrebbe essere quella che un invecchiamento sano abbia posto un vantaggio evolutivo per la sopravvivenza umana. Ci sono ampie prove che i nostri antenati hanno vissuto in un ecosistema terra-acqua, estraendo una parte sostanziale degli alimenti della loro dieta sia dalle risorse terrestri sia acquatiche. Invece di rifiutare questa possibilità per mancanza di prove, l'assunto dovrebbe essere che gli ominidi degli ecosistemi costieri avevano risorse acquatiche catturabili che consumavano. I vantaggi di queste argomentazioni e di queste diete dimostrano il vantaggio di incorporare questa conoscenza nelle raccomandazioni dietetiche per una vita salutare.
Gli adipociti
Gli adipociti sono il maggior tipo di cellule, circa il 30%, che si ritrovano nel suo contesto. Essi contengono, soprattutto, grasso che occupa la maggior parte del loro volume. Sono circondati da tessuto collagene fibroso, da nervi e da vasi sanguigni. Nel telaio di supporto, insieme alla frazione stromale vascolare, sono presenti cellule mesenchimali, fibroblasti, preadipociti, cellule del sangue, muscolari lisce e immunitarie.
Utile è ricordare come gli adipociti derivino dalla differenziazione delle cellule staminali mesenchimali, come le stromali del midollo, i cardiomiociti, gli angiociti, i mioblasti scheletrici, gli osteoblasti, i condroblasti, i tenoblasti, i neuroblasri. In tal modo, il tessuto adiposo deve considerarsi una ricca fonte di cellule mesenchimali non embrionali, la cui relativa facilità di accesso e la cui capacità di differenziarsi in altre cellule aprono l’ipotesi e la strada ad applicazioni mediche promettenti.
Il tessuto adiposo dei mammiferi è poi distinto in BAT (brown adipose tissue) e WAT (white adipose tissue). Negli esseri umani la maggior parte dei grassi è presente nel WAT.
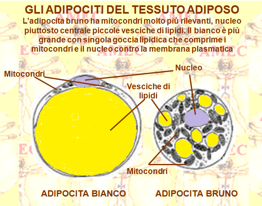
Il tessuto adiposo bruno, la cui distribuzione è principalmente riscontrabile negli animali che vanno in letargo, è scarsamente presente nell'uomo adulto. È più rappresentato nei neonati ed è così chiamato per la colorazione bruna visibile a fresco per effetto dei carotenoidi dei mitocondri.

La sua principale funzione è di produrre calore in risposta alle basse temperature, secondo la così detta termogenesi da freddo o NST (non shivering thermogenesis). Tale attività corrisponderebbe al 5% del metabolismo basale. Nelle membrane mitocondriali è, in effetti, presente l'UCP1 (uncoupling protein 1), proteina detta disaccoppiante, in grado di produrre calore dall'ossidazione degli acidi grassi. Questa cellula riceve una particolare innervazione e vascolarizzazione per le quali riesce a regolare l'attività termogenica e la diffusione rapida del calore in tutto il corpo.
Una caratteristica peculiare dell'innervazione dell’adipocita bruno risiede nei recettori (b3) della membrana cellulare che mediano la risposta metabolica e, quindi, la produzione di calore in base all'attività della cellula nervosa con cui sono a contatto. L'attività termogenica di queste cellule aumenta tramite la stimolazione nervosa in risposta all'esposizione al freddo e all'aumento dell'introito calorico.
Il WAT risponde a diversi ruoli, quali quello dell’isolamento termico, dell’ammortizzazione meccanica e della riserva energetica. In tal caso, il tessuto adiposo è costituito nella maggior parte da adipociti colmi di lipidi, tenuti insieme da una struttura di fibre di collagene.
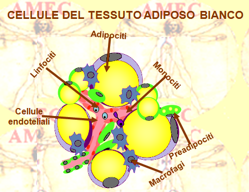
Sono, peraltro, presenti, come prima accennato, altre cellule vascolari stromali, leucociti, macrofagi e preadipociti. Le cellule adipose bianche hanno vascolarizzazione limitata e ricevono un flusso di sangue variabile sulla base del peso corporeo e dello stato nutrizionale. Nel WAT, in occasione del digiuno, aumenta il flusso del sangue.
Sino a pochi anni fa l’adipogenesi era considerata una funzione a termine nei primi anni di vita con la definizione del futuro degli individui in magri o obesi in ragione del numero fisso degli adipociti predestinati alla nascita. Invece, oggi è ormai noto che il grasso dell’organismo è sede di un turn-over dinamico attraverso il quale le cellule staminali mesenchimali sono impegnate nei processi di proliferazione in preadipociti, di arresto della loro crescita e di differenziazione in adipociti maturi. In tal modo, il numero degli adipociti dipende da un equilibrio tra l’adipogenesi e l’apoptosi. Si ritiene, invero, che, nell’adulto di ogni età e con tutti i gradi d’indice di massa corporea, ogni anno circa il 10% delle cellule adipose si rinnovino.
Ne consegue che durante un bilancio calorico positivo la compromissione della fase di reclutamento, di proliferazione o di differenziazione adipogenica potrebbe causare un processo patologico del tessuto adiposo e/o conseguenze metaboliche negative, soprattutto nei casi geneticamente predisposti o sottoposti a particolari condizioni ambientali.
La differenziazione degli adipociti
La differenziazione degli adipociti, processo altamente controllato, è stata ampiamente studiata negli ultimi venticinque anni con due diversi modelli di sperimentazione in vitro, essenziali nel determinare i meccanismi coinvolti nella proliferazione, differenziazione e secrezione delle adipochine. Sono, difatti, attualmente disponibili: le linee cellulari dei preadipociti già impegnati nel lignaggio delle mature e delle staminali multipotenti, in grado di impegnarsi in linee diverse, tra cui quella adiposa, quella ossea e quella muscolare. Diversi eventi possono contribuire all'impegno di discendenza degli adipociti da parte di una cellula mesenchimale staminale, compreso il coordinamento di una rete complessa di fattori di trascrizione, di cofattori e di segnali intermedi di numerosi percorsi. Le nuove cellule del grasso derivano costantemente da una popolazione preesistente di cellule progenitrici indifferenziate o attraverso la dedifferenziazione degli adipociti a preadipociti, che a loro volta proliferano e si ridifferenziano in adipociti maturi. L’analisi del turnover ha dimostrato che gli adipociti rappresentano una popolazione di cellule altamente dinamica e regolamentata. L’adipogenesi, di fatto, è un processo di più fasi che coinvolge una cascata di fattori di trascrizione e l'espressione genica di controllo delle proteine del ciclo cellulare. Negli ultimi anni molti studi hanno chiarito i diversi regolatori positivi e negativi di questa rete.
José María Moreno-Navarrete e José Manuel Fernández-Real dell’IDIBGi di Girona, Spain hanno di recente pubblicato una recensione focalizzando proprio i processi cellulari associati alla differenziazione degli adipociti, inclusi i fattori trascrizionali, i cofattori e i modulatori extranucleari. Hanno anche riassunto il ruolo dei fattori dell’epigenetica, il microRNA e la cronobiologia nell’adipogenesi (M.E. Symonds (ed.), Adipose Tissue Biology, © Springer Science+Business Media, LLC 2012).
Principali funzioni degli adipociti e loro corrispondenti fattori
Peraltro, è pur vero che la massa del tessuto adiposo è in funzione sia del numero degli adipociti sia della loro dimensione. Il primo è controllato da una parte dall’apoptosi / necrosi e dall’altra attraverso lo sviluppo e la differenziazione delle cellule progenitrici, i preadipociti. Un aumento della massa del grasso corporeo può verificarsi per la differenziazione dei preadipociti, ma anche per il maggior deposito dei lipidi nelle cellule. Nell’uomo ai due periodi di crescita iperplastica normali, relativi al terzo trimestre di gravidanza e alla pubertà precoce, se ne possono anche aggiungere altri nell’età adulta.
Una criticità di grandezza degli adipociti stimola, generalmente e con consequenziale aumento del numero delle cellule, i preadipociti a differenziarsi. Ciò può verificarsi in caso di sovralimentazione a lungo termine con mantenimento in vita degli adipociti, secondo un meccanismo di segnali, in parte geneticamente determinato ma ancora non ben definito.
Peraltro, nel WAT, per quanto riguarda il tasso dell’apoptosi e il numero e la differenziazione delle cellule progenitrici, esistono differenze tra i depositi del grasso sottocutaneo e di quello viscerale. Le diversità riguardano anche le risposte a determinati stimoli, come quella del TNF-α (tumor necrosis factor-alpha) sull’apoptosi e quella dei PPAR-γ (peroxisome proliferator-activated receptor-gamma) sulla proliferazione. Si è appurato che, per quanto riguarda lo sviluppo delle alterazioni metaboliche e infiammatorie, l’obesità determinata della crescita delle cellule iperplastiche sia più benigna dell’ipertrofia degli adipociti in cui la cellula di grasso ha diminuito la sua capacità di immagazzinare i trigliceridi.

Oltre allo stoccaggio di energia, il tessuto adiposo svolge un ruolo attivo in molti processi omeostatici, incluse le spese di energia, la regolazione dell'appetito e del metabolismo del glucosio. Inoltre, il tessuto adiposo è fondamentale per la funzionalità tiroidea, la risposta immunitaria, il mantenimento della salute delle ossa, la riproduzione e la coagulazione del sangue. Questi processi sono regolati da una varietà di percorsi e d’interazioni ormonali.
A tal proposito, il tessuto adiposo oggi è ormai definito come un attivo organo endocrino con secrezione di acidi grassi liberi, di leptina, di adiponectina, di adipsina, del complemento 3, dell’IL-6 (interlukin-6), del TNF-α, dell’angiotensinogeno e del PAI-1 (plasminogen activation inhibitor-1). I segnali anormali e i deficit o la resistenza riguardo a questi ormoni hanno dimostrato di avere effetti deleteri.
Distribuzione anatomica del tessuto adiposo
Continuamente stimolati dalla crescente epidemia dell’obesità e dei suoi danni sull’organismo, gli studiosi si sono sempre più dedicati a far luce sul significato della differente distribuzione del grasso corporeo, in ragione soprattutto alle implicazioni cliniche, in modo da suggerire le norme più efficaci e razionali di prevenzione e di cura. Il tessuto adiposo è, difatti, anatomicamente distribuito in proporzioni diverse in tutto il corpo umano e il modello di distribuzione dipende da molti fattori, tra cui il sesso, l’età, la razza, l’etnia, il genotipo, la dieta, l'attività fisica, i livelli di ormoni e anche i farmaci. Peraltro, la sua percentuale nell’organismo è più alta nelle donne, negli anziani e nel sovrappeso. Tradizionalmente esso è distribuito in due scomparti principali con caratteristiche metaboliche differenti: il tessuto adiposo sottocutaneo (SAT) e quello viscerale (VAT). Entrambi questi tipi sono importanti, ma particolare attenzione è rivolta da qualche tempo, a causa della sua associazione con varie patologie mediche, al viscerale.

In particolare, numerose evidenze hanno ormai indicato come il tessuto adiposo viscerale rappresenta un organo endocrino attivo del grasso corporeo totale con caratteristiche uniche biochimiche che influenzano numerosi processi normali e patologici. Più precisamente, in caso di sua abnorme presenza in un individuo, si configura un processo patologico caratteristico conosciuto oggi giorno come “obesità viscerale” o “obesità centrale”. Si tratta di un vero e proprio fenotipo di composizione corporea che si associa, di fatto, a malattie come le cardiovascolari, i tumori e la sindrome metabolica. Ne consegue, pertanto, che riconoscere e definire clinicamente la misura dell’obesità viscerale rappresenta un’importante strategia di studio clinico diagnostico e anche prognostico del malato per la valutazione attenta e precisa dei potenziali rischi di sviluppo delle malattie correlate all’obesità.
In effetti, la sua distribuzione influisce differentemente sulla resistenza all'insulina in rapporto all'accumulo del grasso nel VAT (visceral adipose tissue) e nel SAT profondo (subcutaneous adipose tissue), piuttosto che nel SAT superficiale.
Da notare che il VAT deve contribuire normalmente nell’uomo per i soli 7-15% del grasso corporeo totale.
Thomas EL dell’Hammersmith Hospital, London, UK e collaboratori hanno si sono proposti di calcolare un intervallo di riferimento per il tessuto adiposo totale e quello regionale (AT) così come per il grasso ectopico nel fegato e nei muscoli di soggetti sani (Obesity (Silver Spring). 2012 Jan;20(1):76-87). Questi dati sono, difatti, interessanti e importanti per la differenzazione dei compartimenti individuali di adiposità in rapporto alla possibile associazione con i fattori di rischio metabolici, l'obesità e la resistenza all'insulina. In effetti, l’eccedenza di quanto previsto dagli indici clinici di obesità del tessuto adiposo intraddominale (IAAT) ed epatico può essere, anche in condizioni di normalità di misure antropometriche, ad aumentato rischio delle malattie metaboliche. Vi è, quindi, la necessità di una quantificazione precisa di questi depositi potenzialmente pericolosi con l'individuazione di nuovi subfenotipi. Gli Autori hanno, così, studiato la relazione tra età, massa corporea, BMI, circonferenza vita (WC) e distribuzione dell’AT usando la MRI (magnetic resonance imaging) di tutto il corpo in 477 volontari bianchi, di cui 243 maschi e 234 femmine. Inoltre, hanno usato la MRS (magnetic resonance spectroscopy) per determinare il contenuto dei lipidi intraepatocellulari (IHCL) e intramiocellulari (IMCL). La variabile antropometrica che forniva la correlazione più forte individuale per l'adiposità e gli ectopici depositi di grasso era la WC negli uomini e la BMI nelle donne. Inoltre, si rivelava una grande variazione nello IAAT, nell’ASAT (abdominal subcutaneous AT) e nei depositi IHCL. Ciò risultava non del tutto previsto dalle misure dell’obesità ottenute clinicamente. Emergeva, pertanto, una subfenotipo precedentemente non identificato con dimostrazione modelli di adiposità regionale specifici per sesso ed età in una grande coorte del Regno Unito identificando anche le variabili antropometriche di migliore previsione prognostica dell’adiposità individuale ed ectopica dei depositi di grasso. Da questi dati gli Autori ritenevano di dover proporre il TOFI (thin-on-the-outside fat-on-the-inside) come subfenotipo per gli individui ad aumentato rischio metabolico.
Lo stesso Thomas EL in una successiva pubblicazione (Nutr Res Rev. 2012 Jun;25(1):150-61) hanno presentato esempi dei fenotipi in rapporto alla distribuzione del grasso corporeo e il valore della loro caratterizzazione. Gli Autori ribadivano, difatti, che l’adiposità in eccesso e in particolare quella addominale ed ectopica devono essere considerate fattori di rischio per lo sviluppo di una serie di gravi malattie croniche. L'avvento delle metodologie d’imaging in vivo che permettono la valutazione diretta del grasso corporeo totale e la sua distribuzione è oggi fondamentale in questo processo. Si possono, in tal modo, individuare, difatti, una serie di sotto-fenotipi nella popolazione generale i cui fattori di rischio metabolici non sono commisurati al loro indice di massa corporea. A oggi, sono stati individuati almeno due di questi sottofenotipi: soggetti con BMI normale, ma con eccesso del grasso viscerale intraaddominale, con o senza aumento di grasso ectopico, e soggetti con BMI elevata > 25 kg / m 2, ma con basso grasso viscerale ed ectopico. Il primo subfenotipo si associa con i profili metabolici negativi, mentre il secondo con fenotipo metabolicamente normale, nonostante l’elevata BMI.
Charles W. Rehrer dell’University of Colorado School of Medicine, USA e collaboratori, sulla base della differenza funzionale e metabolica del tessuto adiposo (AT) situato nei visceri rispetto al deposito sottocutaneo (SAT), considerato, peraltro, naturalmente omogeneo nelle regioni generalizzate (Obesity Volume 20, Issue 11, pages 2168–2173, November 2012), hanno usato l’Array GeneChip human Exon 1,0 ST dell’Affymetrix per determinare in donne di peso normale l'espressione genica differenziale nei depositi adiposi dell’addome superiore e basso, dei fianchi e delle anche. Era differenzialmente espresso un totale di 2.890 / 24.409 trascrizioni tra tutti i siti. Quando si confrontavano l'anca e il fianco al basso ventre, vi erano rispettivamente 248 e 83 geni espressi differenzialmente. Nel confronto tra l'anca e il fianco alla parte superiore dell'addome, vi erano rispettivamente 2.480 e 79 geni. Nessun gene era significativamente differente quando il basso addome era confrontato con l'addome superiore e l'anca al fianco. I geni coinvolti nelle cascate del complemento e della coagulazione e le risposte immunitarie mostravano una maggiore espressione nel basso addome rispetto al fianco. Inoltre, due geni, coinvolti nella cascata della coagulazione e del complemento, CR1 e C7, erano espressi maggiormente nell'addome inferiore rispetto al fianco. I geni coinvolti nel metabolismo biochimico di base, compresi la segnalazione d’insulina, il ciclo dell'urea, il metabolismo del glutammato, il metabolismo dell’arginina e della prolina e il metabolismo degli aminozuccheri avevano una più alta espressione nel basso addome rispetto al fianco.
Questi risultati nelle donne di peso normale sane, secondo gli Autori, offrirebbero una nuova prospettiva sulle differenze regionali biologiche del SAT che può avere implicazioni fisiopatologiche quando si raggiungono i valori dell’adiposità.
Tecniche di valutazione del grasso viscerale
A tutto oggi, si sono sviluppate numerose tecniche per la valutazione del grasso viscerale alla ricerca continua di quella più conveniente ai fini clinici per caratteristiche di praticità, di semplicità e di rapidità di esecuzione con risultati immediati, senza bisogno di grande formazione tecnica.
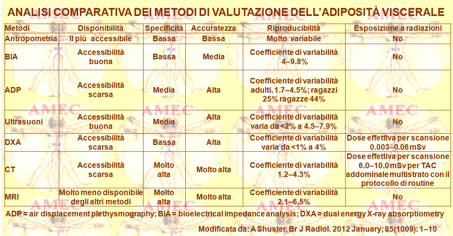
Le tecniche antropometriche si basano su misurazioni di gran valore pratico, anche se non precise. Sono riferite al calcolo della BMI (body mass index), della WHR (Waist-to-hip ratio), della WC (waist circumference), del diametro sagittale addominale e di altre misure addizionali. Non forniscono valutazioni quantitative, ma costituiscono il metodo più semplice e più rapido di valutazione.
La BIA (bioelectrical impedance analysis) è un esame bioelettrico quantitativo e qualitativo della composizione corporea, valutata sulla base della resistenza e della reattanza di una debole corrente elettrica che attraversa il corpo umano. La differente velocità della corrente, che passa attraverso l’organismo, condizionata dall’acqua presente nei tessuti, fornisce le percentuali di massa magra e di quella grassa. È noto, difatti, che l’acqua è contenuta nella quantità dal 65 al 70% nei muscoli e nel 50% circa nel grasso. Si tratta, in effetti, di una tecnica precisa entro i limiti dello 0,2%. È, peraltro, piuttosto complessa, anche se poco invasiva ottenendosi con l’applicazione di elettrodi in diverse parti del corpo. Offre valutazione indiretta, misurando la tensione di corrente tra l'ombelico e la parte posteriore. Richiede qualche minuto, equazioni predittive, non competenze specifiche, ma un limite massimo del peso.
L’ADP (Air displacement plethysmography) è una tecnologia relativamente nuova, basata sul rapporto tra pressione-volume per stimare il volume e la densità del corpo. Essa è rapida e non invasiva ed è possibile anche nei casi di obesità patologica. Ha necessità del controllo della temperatura e dell'umidità e richiede una complessa manovra di respirazione da parte del paziente. Offre una valutazione indiretta, monitorando i cambiamenti della pressione all'interno di una camera chiusa. Però, rischia di sottovalutare spesso il volume del grasso corporeo.
La DEXA (Dual Energy X-ray Absorptiometry) si basa sulla rilevazione di tre componenti tessutali dell’organismo: il muscolo, il grasso e l’osso. Si ricorre a un particolare apparecchio a raggi X che scansiona il corpo. La dimensione dell'area di scansione restringe le possibilità di un peso superiore. È, comunque, necessario uno speciale software. Offre una valutazione indiretta, misurando la totalità del corpo e le masse grasse del tronco.
Pur tuttavia, l’ADP e la DXA possono fornire solo stime dell’adiposità viscerale in quanto non in grado di distinguere tra i diversi depositi del tessuto adiposo. Per tutto quanto riportato, queste tecniche vengono, quindi, riservate ai soli fini di ricerca perché abbastanza costose e di difficile esecuzione.
L'ecografia è un'altra tecnica adatta per la stima del tessuto adiposo sottocutaneo e intraddominale. È una pratica rapida, ma con scarsa riproducibilità e precisione per cui è da più parti poco raccomandata. Offre una valutazione indiretta, misurando la distanza tra la faccia interna del muscolo retto-addominale e la parete anteriore dell'aorta. Richiede una particolare capacità e formazione dell'operatore, da cui dipendono l’affidabilità e la precisione dei risultati.
In definitiva, l’analisi antropometrica e quella della BIA rappresentano le misure pratiche, ma non raffinate, della composizione corporea, fornendo, però, solo una definizione indiretta del VAT.
Attualmente, il gold standard per la valutazione quantitativa più precisa, specifica e completa della distribuzione del tessuto adiposo del corpo è rappresentato dalla TAC e dalla RM. Esse, difatti, rappresentano i metodi diretti di valutazione della deposizione del grasso viscerale, sia nell’adulto sia nel bambino.
La TAC fornisce lo studio dei diversi strati di tutto il corpo e necessita per l'analisi di uno specifico software.
La RMN offre una durata della scansione di circa 14-18 s e il protocollo di una singola fetta è accurato come la multipla.
Purtroppo, le due metodologie sono costose, in specie la RM, e, quindi, anche meno disponibili. Un altro limite risiede nell'obesità molto grave per le problematiche strutturali del paziente che non permette la materiale applicabilità di esecuzione.
A Shuster, della McMaster University, Hamilton, Ontario, Canada e collaboratori, ribadendo che l’accurata valutazione quantitativa del grasso viscerale è essenziale nella valutazione del potenziale rischio per lo sviluppo delle gravi malattie mediche, hanno discusso proprio di recente le tecniche della sua misurazione nei loro meriti di accessibilità, specificità, precisione e capacità di valutazione quantitativa (Br J Radiol. 2012 January; 85(1009): 1–10).
Obesità, patologia a basso grado d’infiammazione cronica
Quando aumenta il peso corporeo sino ai valori dell’obesità, si sviluppa il processo dell'infiammazione nel grasso e nel fegato. Con la secrezione delle citochine infiammatorie, come l'interleuchina (IL) -6 che impedisce il corretto funzionamento dell'insulina, si sviluppa resistenza all'insulina e, quindi, il diabete di tipo 2. Queste molecole sono prodotte dal sistema immunitario, così come dal tessuto stromale. A tale proposito, bisogna ricordare che sono in atto numerosi studi su come il sistema immunitario risponde al grasso e all’obesità. Le ricerche si sono, quindi, focalizzate sui macrofagi, adibiti a eliminare con la proprietà della fagocitosi le cellule morte. Difatti, nel caso degli adipociti che vanno in necrosi, perché divenuti troppo grandi, i macrofagi intervengono con funzioni di ripulitura, ma con il consequenziale sviluppo di una super infiammazione che diventa l’evento chiave del processo rigenerativo. I neutrofili sono i primi a intervenire dopo poche ore, attivando il processo della fagocitosi.

Subito dopo qualche ora, agiscono i monociti e i macrofagi che rimuovono i detriti cellulari. A tale proposito è bene notare che esistono due classi di macrofagi: gli M1, così detti cattivi, e gli M2, denominati buoni. I primi invadono subito dopo i neutrofili il tessuto danneggiato e hanno funzione infiammatoria e di fagocitosi. Gli M2, invece, hanno funzione antiinfiammatoria, producono le citochine antinfiammatorie IL-4/16/12 e attivano la componente staminale. Pertanto, è importante riconoscere il differenziale reclutamento delle componenti infiammatorie e comprendere la diversa condizione al momento di ogni intervento, soprattutto terapeutico. In condizioni patologiche questo processo è alterato, perché se l’infiammazione è un meccanismo vitale per il tessuto in risposta a un danno, persistendo oltre misura, determina il viraggio della patologia da acuta a cronica, bloccando il processo rigenerativo del tessuto. In conclusione, quindi, l’infiammazione ha il ruolo importante e necessario perché s’innesti l’attivazione della fase rigenerativa, ma solo se si risolve tempestivamente. In tutto questo i macrofagi M2 svolgono la loro preziosa azione risolvendo la risposta infiammatoria e non permettendo più il reclutamento di altre cellule infiammatorie, ma solo di quelle che procedono nella fase della rigenerazione tissutale. Normalmente, in effetti, nel grasso umano vi sono gli M2 con l’attività protettiva di aiuto ai tessuti al rimodellamento e alla modulazione del processo dell'infiammazione. Pur tuttavia, nel caso dell’obesità gli stessi, inspiegabilmente ancor oggi, vengono sostituiti dagli M1 che rilasciano citochine infiammatorie come IL-6, IL-1, e il TNFα (tumor necrosis factor-alpha), con consequenziale resistenza all'insulina e progressione verso il diabete. Da notare, al proposito, che anche l'adipocita può comportarsi come una cellula infiammatoria. Negli esperimenti di manipolazione sul sistema immunitario dei topi, infatti, è stata dimostrata un’infiammazione autoctona nel tessuto adiposo, proprio per diretta partecipazione degli stessi adipociti. Questo potrebbe permettere lo sviluppo di strategie in grado di bloccare l'infiammazione nello stesso tessuto adiposo, senza compromettere il sistema immunitario. Si potrebbe, difatti, disporre di farmaci molto meno tossici di quelli di attacco ai macrofagi, che non sarebbero repressi dal fornire la loro utile e importante ruolo in difesa dell’organismo contro batteri e infezioni.
In definitiva, il processo dell’infiammazione, se rappresenta una risposta naturale difensiva dell’organismo contro gli agenti patogeni esterni, gioca anche un ruolo importante nello sviluppo delle malattie croniche e viene oramai sempre più riconosciuto appannaggio del processo dell’invecchiamento. Significativa risulta, difatti, la correlazione positiva tra la fragilità dell’anziano e l’IL-6, la proteina C-reattiva, l'emoglobina, l’espressione CCR5 delle cellule T, il numero dei monociti nel sangue periferico e il totale dei globuli bianchi. Peraltro, la senescenza si accompagna, in genere, anche all’obesità generale, particolarmente centrale, che contribuisce a una serie d’importanti problemi di salute. Per tutto questo il tessuto adiposo bianco è stato proposto come un regolatore chiave della speranza di vita.
Carey N. Lumeng dell’University of Michigan e collaboratori, proprio considerando la mancanza di studi sui leucociti del tessuto adiposo in rapporto all'invecchiamento con precisazione dell'eterogeneità dei macrofagi presenti (ATM) e sull’influenza dell'età su altre cellule come le T, hanno effettuato un esame dettagliato sperimentale su topi giovani e meno utilizzando lo stato dell'arte delle tecniche (J Immunol. 2011 December 15; 187(12): 6208–6216). I risultati del lavoro dimostravano con l'invecchiamento cambiamenti qualitativi degli ATM per una diminuzione del tipo residente 2 (M2). Gli ATM nel grasso degli anziani viravano verso un ambiente proinfiammatorio con aumento del numero delle cellule doppiamente negative CD206-CD11c- Il meccanismo di questo cambiamento con l'invecchiamento nel profilo fenotipico degli ATM risultava correlato con una riduzione dell’espressione PPARy. Inoltre, si rilevava, sempre con l'invecchiamento, un’espansione profonda e inaspettata delle cellule T del tessuto adiposo viscerale (ATT) con inclusa una significativa induzione delle cellule T regolatorie (Treg) nel grasso.
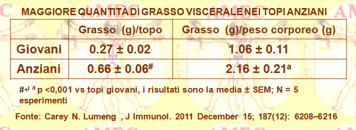
I risultati, secondo gli Autori, dimostravano un'impronta univoca di cellule infiammatorie nel contesto fisiologico dell’invecchiamento del tessuto adiposo, differenziale rispetto a quella indotta dalla dieta nell’obesità.
Il tessuto adiposo come organo immunitario
Dietro la scorta di quanto riportato si può considerare, quindi, l’obesità una condizione patologica a basso grado d’infiammazione cronica, fortemente legata ad avversi esiti metabolici.

Di conseguenza, come accennato, il tessuto adiposo esprime citochine pro-infiammatorie che propagano risposte infiammatorie sistemiche, con effetto anche in altra parte, promuovendo in tutto l’organismo la resistenza all'insulina con il consequenziale esaurimento delle isole delle β-cellule del pancreas. Pertanto, la resistenza all'insulina diventa la fase iniziale del diabete di tipo 2. Tuttavia, vi è evidenza d’individui obesi che non sviluppano il diabete. Tale dato indica, in effetti, che i meccanismi che regolano l'associazione tra i fattori infiammatori e l'aumento del diabete di tipo 2 sono molto più complessi e che meritano ulteriori indagini.
Macrofagi del grasso e loro ruolo locale e sistemico
Bouloumié Annea della Johann Wolfgang Goethe University, Frankfurt-Germany e collaboratori hanno riassunto i dati sulla caratterizzazione della popolazione dei macrofagi nel tessuto adiposo prendendo in considerazione la loro origine, destino e attivazione (Curr. Opin. Clin. Nutr. Metab. Care, July 2005, 8 Issue 4: 347-354).
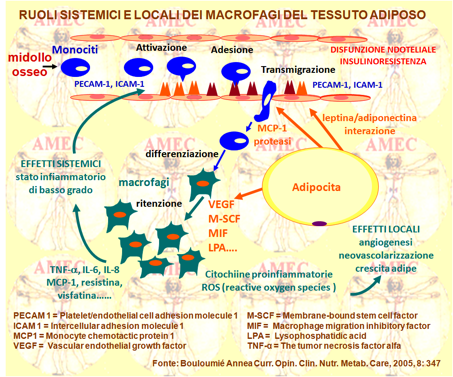
Hanno anche esaminato il loro potenziale coinvolgimento nel tessuto adiposo nello sviluppo della resistenza all'insulina e delle patologie vascolari, così come nel controllo della crescita del tessuto adiposo e nel suo metabolismo.
Tessuto adiposo, infiammazione, insulinoresistenza e diabete
Anca D. Dobrian dell’Eastern Virginia Medical School Norfolk, VA, USA ha recentemente pubblicato una revisione con lo scopo di evidenziare i principali risultati relativi all’espressione della Twist 1, a localizzazione subcellulare nel nucleo, nei diversi depositi di grasso e delle componenti cellulari dell’AT (adipose tissue) e per discutere i potenziali meccanismi che suggeriscono il suo ruolo nel metabolismo, nell'infiammazione e nel rimodellamento dell’AT stesso (Obesity (Silver Spring). 2010 May;18(5):879-83). Le Twist-1 e Twist -2, proteine con ruoli chiave per la regolazione trascrizionale nelle linee cellulari mesenchimali, appartengono alla superfamiglia delle proteine bHLH (basic helix-loop-helix) e hanno una caratteristica bi funzionale, sia come agenti di attività sia come repressori della trascrizione genica. Le proteine Twist presentano una bassa espressione nei tessuti degli adulti, potendola ripresentare in maniera abbondante nelle cellule in via di trasformazione maligna. Peraltro, recenti studi indicano un ruolo innovativo per la Twist-1, come regolatrice potenziale del rimodellamento e dell’infiammazione nel tessuto adiposo (AT). Alcuni studi avrebbero suggerito l’importanza determinante dei geni nello sviluppo dell’obesità, nella distribuzione del grasso e nella capacità del rimodellamento dei diversi depositi adiposi. La Twist-1 è abbondantemente e selettivamente espressa nell'AT dell’adulto e la sua espressione costitutiva, sia nei topi sia negli esseri umani, è significativamente maggiore nel grasso sottocutaneo (SAT) rispetto al viscerale (VAT). Inoltre, negli esseri umani l'espressione della Twist 1 è fortemente correlata con la BMI e la resistenza all'insulina. Tuttavia, i ruoli target funzionali e trascrizionali a valle della Twist 1 nell’AT sono ancora in via di studio.
Essa, comunque, agisce come un regolatore trascrizionale, impedisce la miogenesi con il sequestro delle proteine E, inibendo la trans-attivazione dalla MEF2 e il legame DNA dalla MYOD1 attraverso l'interazione fisica. Questa interazione coinvolge probabilmente i domini di base di entrambe le proteine. Reprime anche l’espressione delle citochine proinfiammatorie, quali il TNFα e l’IL1B. Regola la modellazione e la fusione delle suture craniche. Attiva la trascrizione, come un eterodimero con le proteine E. Regola l'espressione genica differenziale, secondo la composizione del dimero. Gli omodimeri inducono l'espressione del FGFR2 e del POSTN, mentre gli eterodimeri la reprimono e, invece, la inducono a carico del THBS1.
Difetti della TWIST 1 causano la SCS (Saethre-Chotzen syndrome), nota anche come acrocefalosindattilia tipo 3 (ACS3), caratterizzata da craniosinostosi con sinostosi coronale, brachicefalia, bassa attaccatura frontale dei capelli, asimmetria facciale, ipertelorismo, alluci grandi e clinodattilia.
La RSS (Robinow-Sorauf syndrome), anch’essa legata a difetti della TWIST 1 e, peraltro, molto simile alla precedente, è un difetto autosomico dominante, caratterizzata da cranio piccolo, anomalie facciali, dentali e degli arti, come una duplicazione parziale o completa dell’alluce.
Alvehus M dell’Umeå University Hospital - Sweden e collaboratori hanno ipotizzato che l'espressione dei geni infiammatori nel SAT profondo e nel VAT fosse superiore a quella del SAT superficiale (Obesity (Silver Spring, Md.) [2010, 18(5):879-883). Hanno, così, incluso nel loro studio diciassette donne apparentemente sane con BMI 29,3 + / - 5,5 kg/m2, misurando con la DEXA (dual-energy X-ray absorptiometry) il grasso corporeo e con la tomografia computerizzata la sua distribuzione. Hanno anche determinato la sensibilità all'insulina, i lipidi nel sangue e la pressione sanguigna. Hanno, quindi, analizzato le differenze legate all’infiammazione nell'espressione genica con il PCR real-time tra le biopsie del VAT, del SAT superficiale e quello profondo, utilizzando l’analisi univariata e multivariata dei dati. Utilizzando l'analisi di discriminazione multivariata, il VAT appariva come un deposito distinto d’infiammazione del tessuto adiposo, mentre i depositi SAT seguivano, rispetto all’espressione genica, un modello simile. Un’espressione significativamente elevata (P <0,01) del CCR2 (CC chemokine receptor 2) e del MIF (macrophage migration inhibitory factor) nel VAT contribuiva fortemente alla discriminazione.
In conclusione, i depositi del tessuto adiposo umano dimostrano modelli unici infiammatori, con il CCR2 e il MIF differenziali tra il VAT e il SAT.
Harford KA dell’University College Dublin e collaboratori nella loro pubblicazione hanno anche cercato di definire il ruolo dell’accumulo dei macrofagi e delle cellule T nel tessuto adiposo in merito all’obesità, all'infiammazione e all'insulino-resistenza (Proc Nutr Soc. 2011 Nov; 70(4):408-17). Gli Autori hanno voluto ribadire che la dieta ricca di grassi induce, di certo, all’obesità e che, associandosi con uno stato cronico d’infiammazione di basso grado, predispone all’insulino-resistenza (IR), causa a sua volte di diabete di tipo 2. I macrofagi rappresentano una popolazione eterogenea di cellule finalizzate a dare inizio alla risposta immunitaria innata. Le evidenze anche recenti hanno, peraltro, dimostrato la loro mediazione chiave nell’IR indotta dall’obesità con una loro progressiva infiltrazione nel tessuto adiposo. Essi divengono, così, macrofagi classicamente attivati (M1) con proprietà di rilascio di citochine come l’IL-1β, l’IL-6 e il TNFα. Producono in tal modo un ambiente proinfiammatorio che blocca l’azione dell'insulina sugli adipociti e che contribuisce allo sviluppo dell’IR e, quindi, del diabete mellito tipo 2. Nei soggetti magri, invece, i macrofagi sono in uno stato alternativo di attivazione (M2). In tal caso sono coinvolti nella guarigione delle ferite giocando un ruolo importante nella riparazione dei tessuti e nell'omeostasi. Nell’immunoregolazione producono, peraltro, citochine immunoregolatore come l’IL-10, che possono proteggere contro l'infiammazione. Nel tessuto adiposo recentemente è stato anche caratterizzato il ruolo funzionale dell’accumulo delle cellule T. In effetti, le cellule T citotossiche sono effettrici delle T e sono state implicate nel differenziamento, nell’attivazione e nella migrazione dei macrofagi. La loro infiltrazione nel tessuto adiposo dell’obeso dovrebbe, quindi, precedere l'accumulo dei macrofagi. Difatti, le citochine derivate dalle cellule T, come l'interferone γ, promuovono il reclutamento e l’attivazione dei macrofagi M1 amplificando l’infiammazione del tessuto adiposo e l’IR. Variando l’attività e l’accumulo dei macrofagi / cellule T del tessuto adiposo in vivo, attraverso la correzione della dieta di grassi, si può attenuare il tenore dell'infiammazione del tessuto adiposo. Questo risultato deve, difatti, rappresentare un obiettivo terapeutico prioritario per migliorare l’IR indotta dall’obesità.
Esther Titos dell’August Pi i Sunyer Biomedical Research Institute of Barcelona e collaboratori, avendo già precedentemente dimostrato il miglioramento ottenuto con gli acidi grassi ω-3-polinsaturi sull’infiammazione del tessuto adiposo e sull'insulino-resistenza indotte dall'obesità, hanno voluto segnalare (J Immunol. 2011 Nov 15;187 (10):5408-18) i recenti meccanismi alla base delle azioni degli stessi nutrienti sugli adipociti e sulle SVC (stromal vascular cells). Il tessuto adiposo infiammato dei topi obesi sottoposti a dieta ad alto contenuto di grassi, mostrava, difatti, un aumento dei macrofagi F4/80 e CD11b e livelli elevati di IL-6 e MCP-1. L’acido docosaesaenoico (DHA; 4 mg / g) non modificava, peraltro, il numero totale dei macrofagi, ma riduceva significativamente la percentuale delle cellule a espressione di alta CD11b/alta F4/80-, in parallelo con l'emergere dei macrofagi esprimenti la bassa CD11b/F4/80 nel tessuto adiposo. Questo effetto era associato con la sottoregolazione delle adipochine proinfiammatorie in parallelo con l’aumentata espressione dell’IL-10, del CD206, dell’arginasi 1, della RELM-α (resistin-like molecule α) e della proteina chitinase-3 like, indicando un commutatore verso un fenotipo dei macrofagi M2. Questo spostamento era limitato alla frazione delle SVC, in cui la secrezione delle citochine Th1 (IL-6, MCP-1 e TNF-α) era bloccata dal DHA. In particolare, il D1 resolvin attenuava marcatamente l’IFN-γ/LPS, inducente le citochine dei Th1, mentre sopraregolava l’espressione dell’arginasi 1 in un modo dipendente dalla concentrazione. Il D1 resolvin stimolava anche nei macrofagi delle SVC dell’adipe la fagocitosi non flogistica, aumentandone sia il numero con corpuscoli ingeriti sia la quantità di particelle fagocitate, ma anche riducendo la produzione delle specie reattive dell’ossigeno. D’altra parte, non si osservava nessun cambiamento nella zona degli adipociti e della fosforilazione della lipasi ormone-sensibile, un enzima limitante il tasso della lipolisi degli adipociti.
È bene ricordare che la famiglia dei resolvin, tra cui la serie D e l’E, comprende mediatori lipidici endogeni generati dagli acidi grassi polinsaturi omega-3, acido docosaesaenoico (DHA) e acido eicosapentaenoico (EPA). Durante la fase di risoluzione dell’infiammazione acuta i resolvin esercitano potenti azioni anti-infiammatorie e di prorisoluzione in diversi modelli animali. Dati recenti dimostrano, inoltre, che il resolvin E1 e D1 possono attenuare potentemente ogni dolore infiammatorio e postoperatorio.
Questi risultati, in effetti, dimostrerebbero, a giudizio degli Autori, nuovi meccanismi attraverso i quali il D1 resolvin e il suo precursore DHA siano in grado di conferire azioni antiinfiammatorie e proresolving nel tessuto adiposo infiammato.
Serhan CN dell’Harvard Institutes of Medicine, Boston – USA e collaboratori hanno tratto spunto per il loro lavoro (FASEB J. 2012 Apr;26(4):1755-65) dalla scoperta abbastanza recente della nuova famiglia dei potenti mediatori antinfiammatori e di risoluzione spontanea degli essudati e anche dei mediatori lipidici della metabolomica biosintetizzati dai MΦs (macrophages). Gli Autori hanno, così, stabilito che la MAR1 (maresin 1), prodotta dai MΦs umani dal DHA endogeno (docosahexaenoic acid), si potesse abbinare con il sintetico 7R, il 14S-dihydroxydocosa-4Z, l’8E, il 10E, il 12Z, il 16Z, l’acido 19Z-hexaenoic. Il gruppo alcolico della MAR1 e la geometria Z / e di doppi legami coniugati sono stati abbinati utilizzando isomeri preparati per la totale sintesi organica. L’indicazione di potenza delle azioni della MAR1 era confermata con il MAR1 sintetico, cioè, limitando l’infiltrazione dei PMN (polymorphonuclear neutrophil) nella peritonite murina (ng/mouse range), nonché migliorando la captazione dei macrofagi umani dei PMN apoptotici. Al valore di un nM la MAR1 era leggermente più potente del D1 resolvin nella stimolazione dell’efferocitosi dei MΦ umani, azione non condivisa dal leucotriene B (4). La MAR1 accelerava anche la rigenerazione chirurgica nella planaria, aumentando il tasso di ricomparsa del capo. Sulla lesione della planaria si poteva biosintetizzare la MAR1 dal deuterium-labeled (d(5))-DHA, bloccata con l’inibitore della lipossigenasi (LOX). La MAR1 inibiva, in modo dose-dipendente, il TRPV1 (transient receptor potential vanilloid 1) nei neuroni, bloccava le correnti indotte dalla capsaicina (100 nM) verso l'interno (IC (50) 0,49 ± 0,02 nM) e riduceva nei topi sia l'infiammazione sia il dolore neuropatico indotto dalla chemioterapia.
In conclusione, secondo gli Autori, i loro risultati dimostravano le potenti azioni della MAR1 nella regolazione della risoluzione dell’infiammazione, della rigenerazione dei tessuti e della risoluzione del dolore. Si poteva, pertanto, suggerire che i segnali chimici erano condivisi nei percorsi di risoluzione cellulare, per un processo chiave della rigenerazione tissutale. Inoltre, i decisivi fattori della risposta immunitaria innata, come la MAR1, offrirebbero nuove opportunità per la valutazione dei MΦs e della metabolomica del DHA locale per il ritorno all’omeostasi tissutale.
Morris DL dell’University of Michigan Medical School e collaboratori hanno di recente fornito un aggiornamento dello stato attuale delle conoscenze in materia della diversità fenotipica e funzionale degli ATM (adipose tissue macrophages) nei topi magri e obesi e negli esseri umani, proprio in considerazione delle loro proprietà proinfiammatorie che contribuiscono nel determinismo delle comorbilità associate all'obesità (PLoS One. 2012;7(10):e48155). La diversità fenotipica degli ATM è, peraltro, ormai nota e più ampia di quella che riguarda il semplice processo di conversione per effetto dell’obesità da M2 a M1. Le funzioni potenziali degli ATM includono la regolazione della fibrosi e la risposta alla lipolisi acuta negli stati di restrizione calorica. Peraltro, sono stati identificati nuovi percorsi di possibile potenziamento della loro azione, che includono l'attivazione dell’inflammasoma e la risposta al tessuto adiposo lipodistrofico. Ulteriori studi stanno fornendo una nuova valutazione sulla capacità degli ATM di rispondere dinamicamente al microambiente del tessuto adiposo.
In conclusione, secondo gli Autori, gli ATM svolgerebbero un ruolo fondamentale nel plasmare l'ambiente infiammatorio all'interno del tessuto adiposo ed è ormai evidente la loro eterogeneità nello stesso microambiente tanto da doversi aspettare a breve una loro nuova nomenclatura in sottotipi che tenga conto della loro diversità.
Di seguito, lo stesso Alvehus M dell’Umeå University Hospital - Sweden e collaboratori, sulla base dell’accumulo di grasso che caratterizza la transizione della menopausa, tra cui la ridistribuzione dalla periferica ai depositi centrali, in virtù del consequenziale aumento del rischio di diabete di tipo 2 e delle malattie cardiovascolari dovute al basso grado d’infiammazione, hanno voluto verificare la presenza dei più elevati livelli dei marcatori infiammatori nelle donne in questo loro periodo di vita. Hanno anche voluto appurare se questi indicatori si riducessero con la perdita stabile del peso corporeo nelle donne obese (Clinical Endocrinology nov. 2012, 77(5):684-690). Gli Autori hanno, così, raccolto i dati antropometrici, i campioni di sangue e le biopsie del tessuto adiposo sottocutaneo dalle donne di peso normale in premenopausa, in postmenopausa e con obesità prima e dopo i due anni dal bypass gastrico (GBP), analizzando i livelli delle proteine nel siero e l’espressione genica dei marcatori infiammatori nel tessuto adiposo. L’espressione dell’IL-8 nel tessuto adiposo e i suoi livelli circolanti erano più alti nelle donne in postmenopausa vs quelle in premenopausa. Lo stesso dato si associava con la circonferenza della vita, indipendentemente dallo stato menopausale. L’espressione dell’IL-6 e i livelli sierici della MCP-1 (monocyte chemoattractant protein-1) erano più alti nelle donne in postmenopausa vs quelle in premenopausa. Due anni dopo l'intervento di GBP, l’espressione adiposa dell’IL-8, del TNF-α e del MCP-1 era diminuita significativamente. Peraltro, i livelli d’insulina nel siero mostravano un’associazione con l’espressione genica legata all'infiammazione prima del GBP, non più presente dopo l'intervento chirurgico.
In conclusione, le donne in post-menopausa, secondo lo studio degli Autori, avevano una maggiore risposta infiammatoria nel grasso sottocutaneo e nel sangue. I marker infiammatori nel tessuto adiposo erano, peraltro, diminuiti in modo significativo dopo la perdita di peso indotta dall'intervento chirurgico.
Finucane OM del St. James Hospital, Dublin Ireland e collaboratori hanno pubblicato una revisione sul ruolo funzionale dei macrofagi nei riguardi dell’IR (insulin resistance), indotta dall’obesità, sottolineando l'importanza della MIF (migration inhibitory factor) come unica citochina infiammatoria nella diffusione dell’infiammazione e dell’IR, indotte dall'obesità (Proc Nutr Soc. 2012 Nov;71(4):622-33). In effetti, nell’obesità si stabilisce uno stato d’infiammazione cronica di basso grado, di progressiva infiltrazione delle cellule del sistema immunitario, in particolare ATM (macrofagi del tessuto adiposo), caratterizzati da ampia plasticità e nelle fasi iniziali della malattia da una tendenza dei macrofagi M2 anti-infiammatori ad acquisire il fenotipo pro-infiammatorio degli M1. Le citochine proinfiammatorie, tra cui il TNF-α, l’IL-6 e l’IL-1β. prodotte dagli ATM M1, intensificano l'infiammazione locale promuovendo l’IR, che, a sua volta, può portare al diabete di tipo 2 (T2DM). Tuttavia, i trigger responsabili del reclutamento e dell'attivazione degli ATM non sono ancora del tutto compresi. Le chemochine derivate dal tessuto adiposo rivestono, peraltro, il ruolo di attori importanti nel guidare il reclutamento nell’obesità degli ATM. Il MIF, chemochina regolatrice dell’infiammazione, aumenta durante l'obesità ed è direttamente associata al grado dell’IR periferica. Date le sue proprietà chemiotattiche, il MIF può essere un candidato primario durante l'obesità per la promozione del reclutamento degli ATM. Difatti, manipolando opportunamente l’attività del MIF nell'obesità, utilizzando agenti farmacologici o alimenti funzionali, si potrebbero ottenere benefici terapeutici nella prevenzione e nel trattamento delle malattie metaboliche correlate.
Barbarroja N della Fundación IMABIS, Málaga – Spain e collaboratori hanno studiato le differenze di segnalazione insulinica e dei percorsi dell’infiammazione nel sangue e nel tessuto adiposo viscerale (VAT) di venti donatori sani magri e di quaranta obesi patologici (MO), classificati per grado d’insulino-resistenza elevata (alta IR) e stato del diabete (PLoS One. 2012;7(10):e48155). Gli Autori hanno, così, esaminato i cambiamenti dei marcatori proinfiammatori e del contenuto lipidico del siero, dell’infiltrazione dei macrofagi, dell’espressione del mRNA delle citochine infiammatorie e dei fattori di trascrizione, dell’attivazione delle chinasi coinvolte nel processo infiammatorio e dell'espressione delle molecole d’insulina di segnalazione a livello del VAT. Il confronto del VAT di questi gruppi sperimentali rivelava che i soggetti MO diabetici di tipo 2 presentavano lo stesso profilo proinfiammatorio dei pazienti MO ad alta IR. Si documentavano, difatti, elevati livelli di IL-1β, IL-6, TNF, JNK1 / 2, ERK1 / 2, STAT3 e NFκB.
Gli Autori affermavano, così, che il loro lavoro avrebbe escluso l'ipotesi di un aumento dell'infiammazione nei soggetti obesi con diabete di tipo 2, rispetto a quelli con alta IR. Questi risultati indicavano, in effetti, come alcuni meccanismi differenti da quelli dell’infiammazione sistemica e del VAT dovessero essere coinvolti nell’obesità per lo sviluppo del diabete di tipo 2.
Grasso regionale e resistenza insulinica
Tracey McLaughlin della Stanford University School of Medicine California – USA e collaboratori hanno voluto chiarire il rapporto tra grasso regionale e la resistenza all'insulina, indipendentemente dall'obesità (J Clin Endocrinol Metab. 2011 Nov;96(11):E1756-60). Hanno, così, arruolato 115 adulti sani in sovrappeso / moderatamente obesi, con indice di massa corporea (BMI) 25-36,9 kg/m2, resistenti all'insulina (IR) o sensibili (IS), in base al test di soppressione modificato.

La tomografia computerizzata quantificava il tessuto adiposo viscerale (VAT), quello sottocutaneo (SAT) e della coscia. La massa grassa di ogni deposito era confrontata, secondo il gruppo IR / IS, con l’aggiustamento per la BMI e il sesso. Nonostante la quasi simile BMI media dei gruppi, il VAT e il VAT % erano significativamente più alti nel gruppo IR, mentre il SAT, il SAT % e il grasso sottocutaneo della coscia erano significativamente più bassi. Nell'analisi di regressione logistica ogni aumento del VAT aumentava dell'80% le probabilità dell’IR, che si riducevano, invece, del 48% e del 59% per ogni aumento del SAT e del grasso sottocutaneo della coscia. Le significatività si mantenevano anche dopo aggiustamento per gli altri depositi. Quando raggruppati per i terzili del VAT, gli individui IS vs quelli IR mostravano un SAT significativamente maggiore. Non si segnalavano interazioni di queste relazioni con il sesso statisticamente significative.
In conclusione, i dati degli Autori avrebbero dimostrato che, dopo aggiustamento per la BMI e il VAT, la massa grassa sottocutanea addominale e quella delle cosce svolgerebbero azione protettiva contro l'insulinoresistenza, mentre quella del VAT, dopo aggiustamento per il SAT e la BMI, avrebbe effetto opposto.
Rikke Juul Gøbel dell’University of Copenhagen – Denmark e collaboratori, hanno voluto esaminare i biomarcatori dell’infiammazione e quelli legati alla sindrome metabolica (SM) in adolescenti danesi obesi per paragonarli a un gruppo di peso normale (Acta Paediatr, 2012; 101(2):192-200). Hanno, così, reclutato cinquantuno adolescenti obesi e trenta normopeso dai dodici ai quindici anni con misure antropometriche e della pressione sanguigna. Il gruppo degli obesi aveva significativamente livelli più elevati di: pressione sanguigna, insulina, HOMAIR, C-peptide, colesterolo totale, lipoproteine a bassa densità (LDL), trigliceridi, proteina C-reattiva (CRP), interleuchina-6 e fattore di necrosi tumorale alfa, rispetto agli adolescenti normopeso. Al contrario erano bassi i livelli di colesterolo ad alta densità (HDL), mentre non vi erano differenze tra i due gruppi per quanto riguardava il glucosio, gli acidi grassi liberi o la calprotectina fecale, proteina con ruolo di marker dell’infiammazione presente nei granuli citoplasmatici dei granulociti neutrofili, dosabile nei materiali biologici. All'interno del gruppo degli obesi, l’insulina, le lipoproteine a bassa densità di colesterolo, e la CRP risultavano positivamente associate all'indice di massa corporea (BMI) Z-score. La S.M. era presente nel 14% degli adolescenti obesi. Inoltre, negli obesi la CRP correlava positivamente con la maggior parte delle misure antropometriche e nell’analisi di regressione lineare multipla sia la BMI Z-score sia la somma delle pieghe cutanee spiegavano una parte considerevole (R2 = 0,421) della variazione della CRP.
In conclusione, secondo gli Autori, gli adolescenti danesi obesi, ma altrimenti sani, dimostravano un’infiammazione di basso grado con biomarcatori elevati della SM rilevata in alta prevalenza.
L. J. Rasmussen della Northwestern University Feinberg School of Medicine, Chicago, IL, USA e collaboratori hanno esaminato in una coorte longitudinale di 308 adolescenti, all’età di quindici anni, di 218 a diciannove e di 163 a ventidue, le associazioni tra l’adiposità centrale, l’adiponectina sierica e la sensibilità all'insulina derivata con la tecnica del clampaggio (Diabet. Med. 2012, 29, 1153–1158). I volumi del grasso addominale sottocutaneo e di quello viscerale erano misurati all’età media di ventidue anni con la tomografia computerizzata. A ogni esame erano, inoltre, utilizzate, per esaminare le associazioni trasversali, le correlazioni parziali di Pearson e la regressione lineare. La connessione moderatamente negativa risultava significativa tra la circonferenza della vita e l'adiponectina, sostanzialmente invariata dall’età media di quindici anni (-0,32, P <0.0001) sino a quella media di 22 (-0,29, p <0,002), invece quella negativa tra la circonferenza della vita e la sensibilità all'insulina e quella positiva tra l’adiponectina e la sensibilità all'insulina aumentavano costantemente di grandezza all’età media di 22 (-0,29, P = 0.0002 e 0.32, P <0.0001, rispettivamente). Nei modelli di regressione, sia per il grasso viscerale sia per quello sottocutaneo, solo il primo mostrava un’associazione significativa con la sensibilità all'insulina, mentre solo il secondo la mostrava ai limiti della significatività con l'adiponectina.
In conclusione, questo studio dimostrava che la relazione negativa significativa tra la circonferenza della vita e l’adiponectina precedeva lo sviluppo delle relazioni significative tra la sensibilità all'insulina sia con la circonferenza della vita sia con l’adiponectina. Si rilevava anche nei giovani adulti che il grasso sottocutaneo aveva un legame più stretto con l’adiponectina, mentre il grasso viscerale lo aveva con la sensibilità all'insulina.
Anne T. Reutens della Monash University, Melbourne, Vic., Australia e collaboratori sulla base della recente dimostrata associazione tra la cistatina C con il diabete tipo 2 hanno voluto convalidare il dato e studiare l'impatto dell’adiposità basale nei meriti (Nephrol. Dial. Transplant. (2013) doi: 10.1093/ndt/gfs561). Hanno, quindi, valutato l'incidenza a tre anni di diabete in 2.849 partecipanti, senza malattia renale conclamata, di uno studio epidemiologico francese sulla sindrome da insulino-resistenza (DESIR). Hanno, così, aggiustato gli odds ratio (OR) associati alla cistatina C per i fattori classici di rischio del diabete, studiati nei riguardi delle loro interazioni con la cistatina C. Nell'analisi univariata quest’ultima risultava al basale significativamente associata con il diabete (OR / 1 SD di cistatina C log: 1,74; intervallo di confidenza al 95% [IC] 1,33-2,28; P = 0.0001). Ciò si riproduceva anche dopo aggiustamento per età e sesso (OR 1,55, 95% CI 1,15-2,10, p = 0,0039). Quest’associazione, peraltro, era indipendente dalle misure di funzionalità renale di base derivate dalla creatinina sierica e dalla glicemia a digiuno e dalla HbA1c. Una volta usate l'indice di massa corporea (BMI), la circonferenza vita o l'indice di resistenza all’insulina basale come covariate, si registrava un livello d’interazione con la cistatina C. La cistatina C era, peraltro, associata solo con il diabete nelle persone con indice di massa corporea, circonferenza vita o indice di resistenza all'insulina ≥ il valore mediano con OR (IC 95%), rispettivamente di: 1,35 (0,98-1,84, p = 0,0625), 1.39 (1,01-1,91, P = 0,0441) e 1,41 (1,02-1,94, p = 0,0398).
In conclusione, la cistatina C era associata a tre anni con il diabete, ma solo nelle persone con adiposità centrale o insulino-resistenza. Questo dovrebbe essere considerato in ulteriori studi per valutare l'importanza clinica del suo valore prognostico.
Neeland IJ dell’University of Texas Dallas, USA e collaboratori hanno voluto studiare le associazioni tra i fenotipi dell’adiposità e il rischio di prediabete e diabete in una coorte multietnica, basata sulla popolazione di adulti obesi (JAMA. 2012 Sep 19;308(11):1150-9). Hanno, così, misurato in 732 partecipanti obesi con indice di massa corporea ≥ 30 di età compresa tra i trenta e i sessantacinque anni, senza diabete o malattie cardiovascolari, arruolati tra il 2000 e il 2002 nel Dallas Heart Study, la composizione corporea con la DEXA (dual energy x-ray absorptiometry) e la MRI (magnetic resonance imaging), le adipochine circolanti e i biomarcatori dell’insulino-resistenza, della dislipidemia e dell'infiammazione. Hanno anche definito con la tomografia computerizzata e la risonanza magnetica l’aterosclerosi subclinica e la struttura cardiaca. L'incidenza del diabete era studiata in un follow-up medio di 7,0 anni con un range interquartile da 6,6 a 7,6. Inoltre, gli Autori hanno determinato, in un sottogruppo di 512 partecipanti con normali valori di glicemia a digiuno al basale, l'incidenza del composito di prediabete o diabete. Il diabete si sviluppava in ottantaquattro, l’11,5% di 732 partecipanti di età media di quarantatré anni, nel 65% donne e nel 71% non bianchi. All'analisi multivariata la massa di grasso viscerale di base superiore (odds ratio [OR] per uno SD [1,4 kg], 2,4, IC 95%, 1,6-3,7), il livello di fruttosamina (OR per uno SD [1.1 mmol / l], 2.0; 95% IC, 1,4-2,7), il livello di glicemia a digiuno (OR per uno SD [1.1 mmol / l], 1,9, IC 95%, 1,4-2,6), la storia familiare di diabete (OR 2,3, IC 95%, 1.3 - 4.3), la pressione arteriosa sistolica (o per 10 mm Hg, 1.3, aumento di 95% IC, 1,1-1,5) e il peso più alto nel follow-up (OR per 1 kg, 1,06, 95% IC, 1,02-1,10) erano indipendentemente associati con il diabete. Non si osservavano, invece, associazioni per l'indice di massa corporea, il grasso totale o quello addominale sottocutaneo. Tra i 512 partecipanti con i valori normali di glucosio al basale, l'esito composito del prediabete o del diabete si verificava nel 39,1%. Si associava, peraltro in modo indipendente, con le misurazioni della massa grassa viscerale, dei livelli della glicemia a digiuno, dell’insulina, della fruttosamina, dell'età più avanzata, della razza non bianca, della storia familiare di diabete e dell'aumento del peso nel follow-up (p <.05 per ciascuno), ma non con le misure dell’adiposità generale.
In conclusione, l'eccesso di grasso viscerale e l’insulino-resistenza, ma non l’adiposità generale, negli adulti obesi erano indipendentemente associati al prediabete e al diabete mellito di tipo 2.
Lynda E. Polgreen dell’University of Minnesota, Minneapolis USA e collaboratori, sulla base della dimostrata recente associazione dei bassi livelli di osteocalcina (OCN), specifico ormone osteoblastico, con l’insulino-resistenza e l'obesità, in particolare negli anziani, hanno voluto verificare se già nell’adolescenza questo dato potesse rappresentare un fattore riconoscibile per l’adulto (Obesity Volume 20, Issue 11, pages 2194–2201, November 2012). Gli Autori hanno, così, arruolato 137 partecipanti, di cui sessantasette maschi di età media di 18,6 anni con range dai diciassette ai ventidue. Hanno, quindi, misurato i livelli di OCN sottocarbossilata e carbossilata e la resistenza all'insulina mediante il clamp euglicemico-iperinsulinemico (Mlbm). L’OCN totale era inversamente correlata alla BMI, alla circonferenza vita, alla pressione arteriosa sistolica (SBP), all’interleuchina (IL) -6. Si correlava direttamente, invece, alla Mlbm. Solo la SBP, dopo una nuova regolazione per la BMI, rimaneva significativa (con Mlbm p = 0,0560). L’OCN carbossilata era inversamente correlata alla BMI, alla circonferenza vita, alla SBP, alle lipoproteine a bassa densità (LDL-C) e direttamente correlate all’adiponectina. La SBP e l’adiponectina rimanevano significative dopo ulteriore aggiustamento per la BMI. Non c’erano associazioni significative con l’OCN sottocarbossilata.
In sintesi, la maggior parte delle associazioni con l’OCN era mediata attraverso la BMI. Tuttavia, le associazioni significative dell’OCN con la SBP, l'obesità, e l’adiponectina, e borderline con la Mlbm, suggerivano un ruolo potenziale dell’OCN nello sviluppo dell’insulino-resistenza e del rischio cardiovascolare che diventava più evidente con l'invecchiamento.
Adiposità viscerale e alterazione critica delle cellule T
Le evidenze, quindi, confortano l’ipotesi che l’infiammazione adiposa viscerale svolga un ruolo eziologico nello sviluppo dell’insulino-resistenza (IR) nell’obesità e che sia caratterizzata dal precoce e spesso drammatico aumento dell’immunità innata delle cellule, quali i macrofagi. Diversi studi hanno anche dimostrato nel topo e nell’obesità umana un aumento delle sottoclassi ATL (adipose T lymphocyte) del grasso viscerale, come evento primario d’apertura dell’infiammazione e dello sviluppo dell’IR. Peraltro, alcuni studi hanno suggerito un ruolo dei CD8 T, mentre altri quello delle cellule TH1 CD4. Le cellule T regolatorie (Treg) possono svolgere un ruolo critico nella modulazione dei livelli dell’infiammazione del tessuto, tramite le loro interazioni con i diversi componenti del sistema immunitario.
Jeffrey Deiuliis dell’Ohio State University, Columbus, United States of America e collaboratori hanno tratto spunto proprio dallo sviluppo dell’insulino-resistenza (IR) nei modelli murini di obesità e di diabete di tipo 2 (DM), caratterizzata dal progressivo accumulo di macrofagi infiammatori e sottopopolazioni di cellule T nel grasso viscerale per uno studio del ruolo delle cellule T regolatorie (Treg) nel modulare l'infiammazione (PLoS One. 2011 Jan 26;6(1):e16376). Gli Autori hanno per questo ipotizzato che uno squilibrio nelle Treg potesse essere un determinante critico. Gli Autori hanno, così, randomizzato topi "knock-in" GFP (Foxp3-green fluorescent protein) a una dieta ad alto contenuto di grassi per dodici settimane, inducente DIO / IR. Hanno anche arruolato tredici uomini con obesità patologica, senza palese DM di tipo 2, e sette controlli magri in studi prospettici per la valutazione dell’infiammazione adiposo viscerale. La DIO (diet-induced obesity) comportava un aumento delle cellule CD3 + CD4 +, CD3 + e CD8 + del grasso viscerale con una diminuzione notevole dei Treg. L’entità di questi ultimi nel grasso viscerale correlava inversamente con gli ATM (adipose tissue macrophages) CD11b + CD11c +. La misura dei Treg splenici era incrementata con sovraregolazione dei recettori homing CXCR3 e CCR7 e dei marcatori di attivazione CD44. L’analisi in vitro mostrava un’inibizione della differenziazione Treg, in risposta ai mezzi condizionati dai macrofagi infiammatori. Il grasso viscerale umano dell’obesità patologica era, quindi, caratterizzato da un aumento degli ATM CD11c + e da una riduzione dell’espressione Foxp3.
In conclusione, secondo gli Autori, questi dati sperimentali indicherebbero che l'obesità nei topi e nell’uomo si caratterizzerebbe per un esaurimento adiposo dei Treg. Questi cambiamenti sembrerebbero verificarsi con ridotta differenziazione locale, piuttosto che con una compromissione dell’homing. Pertanto, i risultati implicherebbero un ruolo dei Treg come determinanti dell’infiammazione adiposa.












.png)





