NOTIZIARIO Maggio 2012 N°5
"EVIDENZE SUL DECLINO COGNITIVO"
parte II°
A cura di:
Giuseppe Di Lascio §
Susanna Di Lascio***
Con la collaborazione di:
Fattori di rischio e loro ruolo nella transizione verso il DCL (declino cognitivo lieve) e la demenza
Spesso il DCL (Decadimento cognitivo lieve) viene riferito come quella condizione clinica tra la normalità cognitiva e la probabilità di MA (malattia di Alzheimer), ma con possibilità di progressione a forme di demenza non-MA, anche se molte persone rimangono stabili fino alla morte e in alcuni casi possono anche recuperare la regolarità.
Il riconoscimento e la definizione dei fattori di rischio per questi diversi cambiamenti clinici, denominati transizioni, possono, invero, fornire occasioni importanti per i mirati interventi preventivi e terapeutici. Pertanto, gli studiosi, per chiarire questa tematica, sono da qualche tempo impegnati a sviluppare nuovi approcci di ricerca. Per indagare la natura transitoria del DCL amnesico, rappresentato da un solo dominio, e gli stati misti, composti di tutti gli altri sottotipi sulla base delle valutazioni cognitive, sono stati utilizzati anche i modelli di Markov.
Erin L. Abner dell’University of Kentucky e collaboratori, con lo scopo di espandere un modello di rischio includendo come risultato uno stato clinicamente determinato di DCL, hanno svolto un’analisi che ha dimostrato come i diversi fattori di rischio comuni svolgano ruoli diversi nella transizione verso il DCL e la demenza (Int J Alzheimers Dis. 2012;2012:291920). In particolare, l’APOE-4 aumentava il rischio di transizione verso la forma clinica del DCL, ma non influenzava il rischio per un passaggio definitivo verso la demenza.
Ruolo dell’ipertensione nelle transizioni da normale a demenza o a deterioramento cognitivo lieve
A riguardo di quanto riportato in precedenza, R. J. Kryscio dell’University of Kentucky e collaboratori, per verificare se l'ipertensione fosse associata alla transizione dalla condizione cognitiva normale verso il deterioramento cognitivo lieve o verso la demenza precoce, hanno valutato 440 soggetti, arruolati in uno studio longitudinale presso l’University of Disease Center Kentucky di Alzheimer, classificandoli in tre stati transitori a ogni visita: 1) cognitivamente normali, 2) DCL amnesico, 3) DCL misto (Research and Practice in Alzheimer's Disease, vol. 12, pp. 139–143, 2007). Durante il percorso di studio i soggetti sarebbero potuti morire o diventare pazzi. Dopo l’utilizzo di modelli logistici per determinare se le transizioni fossero variate con l’ipertensione dopo l’aggiustamento per età, istruzione, sesso, storia familiare di demenza e stato APOE, i risultati rivelavano che l’ipertensione proteggeva dalla transizione da cognitivamente normali o forme miste di DCL alla demenza (p = 0,0037 e 0,017, rispettivamente) ma non dal DCL amnesico alla demenza (p = 0,92). In conclusione, l'ipertensione si rilevava un fattore di rischio per la morte, ma non per la demenza o per la transizione agli stati di DCL.
Sulla stima d’incidenza e prevalenza del decadimento cognitivo lieve
Per loro parte, Alex Ward dell’United BioSource Corporetion – Lexinton MA USA e collaboratori, con lo scopo di identificare le aree di concordanza e le fonti di variazione per i tassi di prevalenza e d’incidenza delle varie definizioni di decadimento cognitivo lieve (DCL), hanno compiuto una revisione sistematica degli studi nei meriti, pubblicati in lingua inglese dal 1984. Hanno, così, identificato un totale di 3.705 citazioni, selezionandone quarantadue, di cui trentacinque sulla prevalenza e tredici sull'incidenza (Alzheimer's and Dementia, Volume 8, Issue 1, January 2012, Pages 14-21). Predominavano nella letteratura i seguenti quattro termini: 1) l’AAMI (age-associated memory impairment); 2) il CIND (cognitive impairment no dementia); 3) il MCI (mild cognitive decline), 4) l’aMCI (amnestic MCI). La definizione operativa variava all'interno di ogni termine e si osservava una sua sostanziale differenza sia per l’incidenza (MCI: 21,5-71,3; aMCI: 8,5-25,9 per 1.000 anni-persona) sia per la prevalenza (AAMI 3,6% - 38,4%; CIND 5,1% -35,9%; MCI 3 % -42%; aMCI 0,5% -31,9%). Il CIND e il MCI dimostravano, peraltro, crescente prevalenza tra i gruppi di età più avanzata, mentre la frequenza specifica dell’aMCI era più bassa e senza alcuna relazione apparente con l’età. In conclusione, le stime sulla prevalenza e sull'incidenza del DCL variavano molto, rappresentando, così, una sfida significativa per la comprensione del peso sociale di questa malattia. La valorizzazione e la standardizzazione delle definizioni operative dei sottotipi del deficit cognitivo, secondo gli autori, avrebbero potuto migliorare le stime dell’onere e carico della malattia e fornire un meccanismo di facilitazione per l'identificazione degli individui a rischio di un futuro Alzheimer e di altre demenze.
Modelli di stile di vita e rischio di demenza
Il declino cognitivo rappresenta ormai un pressante problema di salute pubblica e, secondo l'Alzheimer Disease International, nel 2010 in tutto il mondo erano affetti da demenza circa 35,6 milioni di persone con un caso ogni sette secondi. Questo numero, destinato a raddoppiare ogni venti anni, raggiungerebbe nel 2050 i 115,4 milioni di persone. Il decadimento cognitivo lieve (DCL) spesso interviene, con problemi del linguaggio, della memoria, del ragionamento, della capacità di risolvere problemi, dell’attenzione o del processo decisionale o di altre funzioni mentali, come prima indicazione di sviluppo della demenza. Queste funzioni mentali o processi cognitivi, indicati come funzioni esecutive, possono essere riconosciute con particolari test e sono evidenti alle persone prossime al malato, ma non interferiscano con la vita quotidiana dello stato del DCL. La diminuzione in tre specifiche funzioni esecutive (attenzione selettiva, funzione di risoluzione dei conflitti, memoria associativa) prevede fortemente che una persona con deterioramento cognitivo lieve finirà per sviluppare la demenza. In definitiva, il decadimento cognitivo lieve, sulla base che circa il 50% dei malati è a rischio di sviluppo di Alzheimer o di altri tipi di demenza, è un riconosciuto segno di allarme precoce. Rappresenta, nel contempo, una critica opportunità d’intervento per modificare la storia della demenza dell’anziano. Nella collettività ormai è di facile riscontro, soprattutto negli anziani, che la frequente partecipazione sociale con il mantenimento di un’adeguata attività fisica tende a conservare le capacità cognitive e ad allontanare il pericolo della demenza. Il coinvolgimento mentale e sociale, ad esempio nel volontariato, anche se non monetariamente produttivo, comporta, di fatto, una minore incidenza della malattia. Così pure, un provvedimento composito sociale con il servizio domestico delle attività di manutenzione della casa si è dimostrato analogamente associato a un migliore stato cognitivo. Molti studi nell'insieme hanno ormai dimostrato che i comportamenti individuali, agendo sui processi neurodegenerativi di base, possono influenzare fortemente la probabilità d’insorgenza del declino cognitivo. Tali risultati portano, così, a individuare sempre più insistentemente gli stili di vita comportamentali che possano rappresentare un rischio di demenza onde poter suggerire gli specifici interventi di prevenzione. In effetti, anche se il rischio di demenza, e in particolare quella di Alzheimer, dipende fortemente dai fattori biologici e genetici, vi è, nella fase del suo sviluppo, in cui gli individui possono modificare gli esiti cognitivi della tarda età attraverso scelte di vita salutari, la flessibilità e la plasticità. In definitiva, gli studi epidemiologici forniscono, sino a oggi, una forte evidenza di associazione tra lo stile di vita e il rischio di demenza. A tal proposito, la riserva cognitiva, che descrive la resilienza del cervello al danno cerebrale, è una proprietà del sistema nervoso centrale riguardo alla prolungata e complessa attività mentale che può portare a un’espressione differenziale delle lesioni cerebrali. Essa è stata valutata utilizzando i dati autobiografici, quali il livello d’istruzione, la complessità occupazionale e le attività mentali stimolanti lo stile di vita.
Maria C. Norton dell’Utah State University e collaboratori, per identificare l’associazione tra i diversi modelli comportamentali, quali dieta, esercizio fisico, interazione sociale, frequenza di partecipazione religiosa in chiesa, consumo di alcol e fumo, con il rischio di demenza, hanno svolto uno studio longitudinale nella contea rurale del nord dell’Utah (J Am Geriatr Soc. 2012;60(3):405-412). Hanno, così, arruolato 2.491 partecipanti senza demenza nel 51% maschi, di età media di 73,0 ± 5,7; con istruzione media di 13,7 ± 4,1 anni, in assenza d’ictus o di traumi cranici nei cinque anni precedenti e che inizialmente non avevano riferito alcun problema nelle attività della loro vita quotidiana. Gli Autori hanno esaminato il tipo di dieta, l’esercizio fisico, la partecipazione religiosa, l’interazione sociale, il consumo di alcol, il fumo. La LCA (Latent class analysis) è stata utilizzata per identificare i modelli tra questi comportamenti. Nel follow-up, in media di 6,3 ± 5,3 anni, erano diagnosticati 278 casi di demenza, di cui 200 di morbo di Alzheimer. La LCA individuava quattro distinte classi di stile di vita: una religiosa non salutare (UH-R; 11,5%), un’altra non religiosa malsana (UH-NR; 10,5%), un’altra ancora sana moderatamente religiosa (H-MR; 38,5%) e l’ultima sana, molto religiosa (H-VR; 39,5%).

L’HR (hazard ratio) dell’UH-NR era = 0.54, P = 0,028, della H-MR = 0.56, P = .003 e della H-VR = 0.58, P = 0,005, dimostrando un rischio significativamente più basso per la demenza rispetto all’UH-R. I risultati erano comparabili per la demenza di Alzheimer, tranne che per l’UH-NR con esito meno definitivo. In conclusione, anche in rapporto a questo studio, gli adulti più anziani e funzionalmente indipendenti sembrerebbero raggrupparsi in sottopopolazioni per distinti modelli comportamentali di stile di vita, caratterizzati da diversi livelli di rischio per la demenza e per la successiva malattia di Alzheimer.
Riserva cognitiva e incidente di demenza
Il concetto di riserva cognitiva ha interessato per decenni il campo della ricerca sulla demenza. I risultati hanno condotto a ritenere che i pazienti, con elevati livelli d’istruzione e / o uno stile di vita più cognitivamente attivo, siano meno suscettibili al decadimento cognitivo. Se tutto ciò possa riflettere la maggiore riserva funzionale o le influenze reali sui meccanismi fisiopatologici della malattia, non è ancora chiaro. Pur tuttavia, arrivare a comprendere questo rapporto è importante per una sempre maggiore attenzione ai trattamenti preventivi che tendano a mantenere integra l’attività mentale per tutta la vita.
Valenzuela MJ e Sachdev P del Prince of Wales Hospital, Sydney, sulla base dei diversi rapporti epidemiologici presenti in letteratura, ma non di una revisione sistematica che mettesse tutti insieme i risultati contrastanti, hanno esaminato quantitativamente le evidenze dell’effetto della riserva cognitiva sull’incidente di demenza (Psychol Med. 2006 Apr;36(4):441-54). Gli studi di coorte sugli effetti dell’istruzione, dell’occupazione, dello stato premorboso dell’IQ (intelligence quotient) e delle attività mentali sul rischio di demenza erano tutti di particolare interesse. Sono stati, così, selezionati ventidue studi che soddisfacevano i criteri d’inclusione e si costatava che la riserva cognitiva superiore si associava a un ridotto rischio d’incidente di demenza (sintesi dell’odds ratio, 0,54; intervallo di confidenza al 95%, 0,49-0,59). Questo effetto era riscontrato in un follow-up medio di 7,1 anni e sul risultato d’integrazione dei dati in più di 29.000 individui. In particolare, l'aumento complessivo dell’attività mentale in età avanzata si associava a tassi di demenza più bassi, indipendentemente da altri predittivi. Inoltre, una relazione dose-risposta era evidente anche tra l'estensione delle complesse attività mentali in età avanzata e il rischio di demenza. In conclusione, lo studio avrebbe dimostrato una robusta evidenza di associazione, nelle prime fasi e quelle medio-tardive della vita tra i modelli complessi di attività mentale e una significativa riduzione del 46% dell'incidenza di demenza. Peraltro, nonostante le differenze nel modo con cui i vari fattori erano misurati, gli effetti relativi dell’alta formazione rispetto alla bassa (OR = 0,53), della complessità del lavoro (OR = 0,56) e del tempo libero alla fine della vita (OR = 0,50) erano molto coerenti. Altri studi prospettici più recenti hanno, peraltro, dimostrato un’associazione dose-dipendente in cui si riduce il rischio di demenza per ogni grado d’impegno per il tempo libero della crescente attività cognitiva.
Stile cognitivo e demenza
In tale contesto, si è sviluppato il LEQ (Lifetime of Experiences Questionnaire), utile per misurare le differenze dello stile cognitivo tra gli individui, integrando le informazioni sulle attività educative, occupazionali e di svago, come il carico di stimolo cognitivo per tutta la durata della vita. I punteggi più alti del LEQ predicono in modo indipendente un tasso di declino cognitivo attenuato nel corso del tempo, come pure una diminuzione del tasso di atrofia ippocampale longitudinale. Tuttavia, non è chiaro se quest’approccio, integrato allo stile cognitivo, possa essere in grado di prevedere l’incidenza della demenza. Inoltre, non esisterebbero studi che abbiano messo sistematicamente a confronto l'impatto di ciascuno di questi componenti da solo, dopo aver controllato gli altri due, o abbiano esaminato se una combinazione critica di fattori a coppie potesse risultare potente come la tripla. Ancora, poiché l'istruzione superiore nei malati già con demenza è stata collegata all’aumento della mortalità, gli effetti dello stile di vita cognitiva sulla sopravvivenza dopo la diagnosi potrebbero dissociare quelli protettivi contro l'incidenza della demenza. Peraltro, fino ad oggi non è stata ancora valutata, con uno studio longitudinale all'interno della stessa popolazione, la questione degli effetti combinati dei fattori dello stile cognitivo sull’incidenza della demenza e sulla sopravvivenza dopo la diagnosi, rispetto al caso isolato. Il CFAS (Medical Research Council Cognitive Function and Ageing Study) è uno studio di coorte multicentrico, basato sulla comunità, in corso da oltre quattordici anni e ben progettato per rispondere alle domande di questa natura. Utilizzando un sottoinsieme di domande derivate dal LEQ che riguardano l’istruzione, la complessità del lavoro e le attività cognitive della parte terminale della vita, disponibili come parte della linea di base e delle domande di screening del Cognitive Function and Ageing Study, Michael Valenzuela del Prince of Wales Hospital, Australia e collaboratori sono stati in grado di valutare il contributo individuale e combinato dei tre fattori principali dello stile cognitivo, sia sull’incidente della demenza sia sul tempo di sopravvivenza (Am. J. Epidemiol. (2011) 173 (9): 1004-1012). I dati, quindi, derivavano dal CFAS su una popolazione di 13.004 persone in Inghilterra e Galles con prima intervista nel periodo 1991-1992 e seguite per dieci anni per l'incidenza di demenza e di dodici anni per la mortalità. Un CLS (Cognitive Lifestyle Score) definiva un insieme di attività cognitive, tra cui l'istruzione, la complessità del lavoro e l'impegno sociale, ed era disponibile per 12.600 persone in tre fasi della vita.
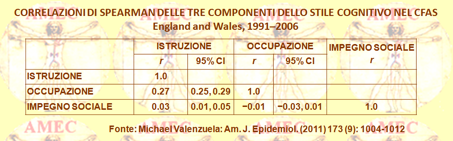
Allo screening basale i partecipanti fornivano informazioni: sullo stato fisico, comportamentale e socio-demografico; sugli aspetti della salute, comprese le condizioni croniche auto-riferite; sullo stato cognitivo derivato dallo MMSE (Mini-Mental State Examination) e dagli elementi selezionati dall’AGECAT (Geriatric Mental State-Automated Geriatric Examination for Computer Assisted Taxonomy). Un CLS superiore risultava protettivo verso la demenza (odds ratio = 0.6, intervallo di confidenza 95%: 0.4, 0.9). Le analisi di sensibilità trovavano l’effetto principale di essere affidabili e ripetibili, anche considerando solo due componenti della partitura, sia l'istruzione e l'occupazione o l'istruzione e l’impegno sociale nella tarda età. Nessun fattore singolo CLS si associava da solo a un'incidenza di demenza. Le differenze di sopravvivenza non raggiungevano la significatività statistica. Pertanto, i dati suggerivano agli autori che più anni d’istruzione, nonché di ulteriori esperienze stimolanti in mezza o avanzata età, sarebbero necessari per una protezione contro la demenza. Si rilevava, invece, dopo la diagnosi di demenza scarsa evidenza dell’effetto dello stile cognitivo sulla sopravvivenza. Ritenuto, quindi, per certo che la riserva cognitiva si associava a un minor rischio di demenza, ma che la misura con cui si delineava nel corso dell’invecchiamento rimaneva ancora poco chiara, Archana Singh-Manoux dell’University College London e collaboratori si sono posti l’obiettivo di esaminare, da diversi punti nel corso della vita, l'impatto dei tre marker di riserva cognitiva sulla funzione cognitiva e sul declino della tarda età adulta (Ann Neurol., 2011, 70: 296–304 Annals of Neurology). Gli Autori hanno raccolto, così, i dati di 5.234 uomini e 2.220 donne di età media di cinquantasei anni, DS = 6 al basale, dalla coorte dello studio Whitehall II. Si sono valutati 3 × 10 anni: la memoria, il ragionamento, il vocabolario, la fluidità fonetica e semantica. Si sono utilizzati modelli misti lineari per valutare l'associazione tra i marcatori di riserva (altezza, istruzione e professione) e il declino cognitivo, utilizzando i cinque test cognitivi e di un punteggio cognitivo globale, derivato da questi test. Tutte le tre misure di riserva si associavano con la funzione cognitiva di base e le più forti erano con l'occupazione, mentre le più deboli con l'altezza. Tutte le funzioni cognitive, tranne il vocabolario, diminuivano nel corso dei dieci anni del follow-up. Nella prova cognitiva globale non vi era una maggiore diminuzione nel gruppo ad alta occupazione (-0,27; intervallo di confidenza al 95% [IC], da -0,28 a -0,26), rispetto al gruppo intermedio (-0,23, 95% IC, -0,25 a -0,22) e al gruppo basso (-0,21 basse, 95% IC, -0,24 a -0,19); p = 0,001. Il calo nei gruppi di riserva, definiti attraverso l'educazione (p = 0,82) e l'altezza (p = 0,55), era simile. La performance cognitiva, pertanto, nel corso della vita adulta era notevolmente più alta nei gruppi a elevata riserva. Tuttavia, il tasso di declino cognitivo, con l'eccezione dell’occupazione, non risultava diverso tra i gruppi di riserva dove si segnava qualche evidenza di una maggiore diminuzione nel gruppo ad alta occupazione.
Nutrienti e funzione cognitiva
Dieta ed esercizio fisico, da lungo tempo associati alle malattie cardiovascolari e al cancro, vengono da emergenti ricerche implicati anche nella protezione del cervello e per scongiurare i disturbi mentali. Dieta, attività fisica e sonno possiedono, difatti, il potenziale per modulare la salute del cervello e la funzione mentale.
Da qualche tempo, l'epidemiologia della malattia di Alzheimer (MA) suggerisce un ruolo preciso della nutrizione nei suoi riguardi. Ciò nonostante, gli studi sulla prevenzione della malattia di una singola o di un gruppo di sostanze nutritive, come quelli riguardanti la vitamine E, del gruppo B o all’acido docosaesaenoico, sono stati deludenti. A tal proposito, per la costruzione di modelli di dieta appropriati sono stati tradizionalmente utilizzati FFQ (Questionari di frequenza alimentare). Tale metodologia, però, anche se relativamente poco costosa e abbastanza completa, non tiene conto della variabilità dell’assorbimento dei nutrienti, né delle problematiche d’insieme dell’anziano.
Dal loro canto Osendarp SJ, dell’UFHRI (Unilever Food and Health Research Institute) e collaboratori, sulla base delle scarse conoscenze sull'effetto combinato dei micronutrienti e degli acidi grassi essenziali sulla funzione cognitiva dei bambini in età scolare, hanno svolto uno studio nei meriti (Am J Clin Nutr. 2007 Oct;86(4):1082-93). Gli studiosi hanno arruolato un totale di 396 bambini di età dai sei ai dieci anni in Australia e 384 bambini in Indonesia, randomizzati a ricevere un drink con un mix di micronutrienti (ferro, zinco, acido folico e vitamine A, B-6, B-12, e C), di DHA (acido docosaesaenoico 88 mg / die, acido grasso omega-3 più abbondante nelle membrane delle cellule nel cervello) e di EPA (acido eicosapentaenoico 22 mg / die), o di entrambi oppure di placebo sei die / sett. per dodici mesi. Gli indicatori biochimici erano determinati al basale e a dodici mesi. La performance cognitiva era misurata al basale, a sei mesi e a dodici mesi. Il trattamento di micronutrienti nei bambini australiani e indonesiani migliorava significativamente le concentrazioni plasmatiche degli stessi. Il trattamento con EPA + DHA aumentava i livelli plasmatici di DHA e il totale degli acidi grassi n-3 plasmaci in entrambi i paesi. In Australia il trattamento con micronutrienti portava ad un aumento significativo dei punteggi nei test di apprendimento verbale e che rappresentano la memoria (dimensione stimata dell'effetto: 0,23, 95% IC: 0,01, 0,46). Un effetto simile si osservava tra le ragazze indonesiane (dimensione stimata in vigore: 0,32, 95% IC: -0,01, 0,64). Nessun effetto si rilevava al test che misurava l'intelligenza generale o l’attenzione. Nessun effetto dell’EPA + DHA si osservava sui fattori dei test cognitivi. Lo studio, quindi, permetteva agli autori di concludere che nei bambini in età scolare e ben nutriti la fortificazione con micronutrienti multipli poteva tradursi in un miglioramento dell'apprendimento verbale e della memoria.
Peraltro, Fernando Gómez-Pinilla dell’UCLA University of California ha dichiarato che il cibo va considerato, in effetti, come un composto farmaceutico che incide sul cervello (Nature Reviews Neuroscience 9, 568-578 (July 2008). Come precedentemente riportato, dieta, attività fisica e sonno hanno, in effetti, il potenziale per alterare la salute cerebrale e la funzione mentale, sollevando l'eccitante possibilità di valide strategie di miglioramento delle capacità cognitive, contrastando e proteggendo, solo con i cambiamenti nella dieta, dai danni dei fattori dell'invecchiamento.
In definitiva, il cibo, classicamente considerato il mezzo per fornire energia e materiali di costruzione del corpo, negli ultimi anni ha incominciato a fornire la prova di poter influenzare specifici sistemi molecolari e i meccanismi che mantengono la funzione mentale. Una dieta ricca di acidi grassi omega-3, infatti, sta ottenendo oggi il riconoscimento di sostenere i processi cognitivi e di regolare i geni importanti per il mantenimento della funzione sinaptica e della plasticità nei roditori. Al contrario, la dieta ad alto contenuto di grassi saturi sta provando di ridurre i substrati molecolari dell'elaborazione cognitiva e di aumentare il rischio di disfunzione neurologica, sia nell’uomo sia negli animali.
Una ricca evidenza paleontologica suggerirebbe, peraltro, una relazione diretta tra l'accesso al cibo e le dimensioni del cervello, ma anche che piccole differenze nella dieta possono avere grandi effetti sulla sopravvivenza e sul successo riproduttivo. Il progressivo aumento della dimensione del cervello si è associato, difatti, con lo sviluppo delle capacità maggiori di vita e di relazione con l’ambiente, sulla base di un migliore coordinamento funzionale e di una maggiore strategia cognitiva per un’alimentazione di successo. L’interazione tra consumo alimentare di acidi grassi omega-3 ed evoluzione del cervello è stata proposta come un ruolo chiave nell’encefalizzazione, ossia nell’aumento del rapporto cervello / massa corporea. L'acido DHA è, difatti, l'acido grasso omega-3 più abbondante nelle membrane cellulari del cervello, ma il corpo umano non è efficiente a sintetizzarlo, per cui è costretto a essere in gran parte dipendente dal suo apporto alimentare della dieta. Negli ultimi cento anni, purtroppo, è aumentata drammaticamente, soprattutto nelle civiltà occidentali, l'assunzione di acidi grassi saturi, l'acido linoleico e acidi grassi trans, mentre si è ridotto il consumo di acidi grassi omega-3.
Da molto tempo l'abbondanza relativa di specifici nutrienti è sotto accusa per essere in grado di influenzare i processi cognitivi e l’emotività. Di recente sono state riconosciute le influenze dei fattori dietetici sulla funzione neuronale e sulla plasticità sinaptica. Si sono anche dimostrati alcuni dei meccanismi vitali con cui la dieta si rende responsabile della salute del cervello e della funzione mentale.

In tale contesto, gli acidi grassi omega-3, presenti nel salmone, noci e kiwi, offrono numerosi vantaggi, tra cui quello di migliorare l'apprendimento e la memoria e quello di contribuire a lottare contro i disturbi mentali, come la depressione e i disturbi dell'umore, la schizofrenia e la demenza. Gli acidi grassi omega-3, come precedentemente detto, sono oggi ritenuti essenziali per la funzione normale del cervello e l’organismo umano, non producendoli sufficientemente, deve procurarseli con la dieta. Supportano, difatti, la plasticità sinaptica e sembrano influenzare positivamente l'espressione di diverse molecole che si trovano nel loro ambito, legate all'apprendimento e alla memoria. A tale riguardo, è bene ricordare che le sinapsi nel cervello collegano i neuroni tra loro e forniscono funzioni critiche, essendo anche sede dell’apprendimento e della memoria. Di fatto, la carenza alimentare di acidi grassi omega-3 negli esseri umani è stata dimostrata in associazione con un aumentato rischio di alcuni disturbi mentali, tra cui il disturbo da deficit dell’attenzione, la dislessia, la demenza, la depressione, il disturbo bipolare e la schizofrenia. Peraltro, in studi sperimentali sui roditori la loro carenza si è associata a compromissione dell'apprendimento e della memoria. D’altra parte, i bambini con aumentata quantità di acidi grassi omega-3 hanno dimostrato di ottenere risultati migliori a scuola, nella lettura e nell'ortografia, fornendo prova di minori problemi comportamentali. Inoltre, in uno studio in Inghilterra studenti, trattati con acidi grassi omega-3, avrebbero dimostrato un migliore rendimento scolastico.
È ancora da notare che diversi ormoni intestinali possono raggiungere oppure prodursi nel cervello. Essi possono, quindi, influenzare la capacità cognitiva. Peraltro, altri fattori, ben consolidati regolatori della plasticità sinaptica, come il brain-derived neurotrophic factor, possono funzionare come modulatori metabolici e rispondere ai segnali periferici, come l'assunzione di cibo. Interpretare le basi molecolari degli effetti del cibo sulla cognizione rappresenta, quindi, il mezzo per poter meglio manipolare la dieta al fine di aumentare la resistenza dei neuroni agli insulti nocivi e di promuovere la salute mentale.
Per loro parte, Solfrizzi V. dell’Università di Bari e collaboratori hanno riassunto il valore dei nutrienti nel prevenire o posticipare l'insorgenza della malattia di Alzheimer (MA) e ritardarne o rallentarne la progressione con consequenziale miglioramento in età avanzata dello stato di salute e della qualità della vita (Curr Alzheimer Res. 2011 Aug;8(5):520-42). In effetti, l’elevata concentrazione di acidi grassi saturi potrebbe avere effetti negativi sul declino e sul decadimento cognitivo lieve correlato all'età. Allo stato attuale, l'evidenza epidemiologica suggerisce, difatti, una possibile associazione tra il consumo di pesce, di acidi grassi monoinsaturi e polinsaturi (PUFA, in particolare n-3 PUFA) e il ridotto rischio di declino cognitivo e demenza. Le più scarse funzioni cognitive e l’aumentato rischio di demenza vascolare (VaD) sono risultati associati a un minor consumo di prodotti lattiero-caseari o di latticini. Così che il consumo di tali alimenti con l’intera composizione dei grassi può associarsi negli anziani al declino cognitivo. D’altro canto, il consumo da lieve a moderato di alcol può associarsi a un ridotto rischio di demenza e di MA, mentre l'evidenza attuale è solo indicativa di un effetto protettivo per la VaD, per il declino cognitivo e per le sindromi predemenziali. D’altro canto, le limitate evidenze epidemiologiche disponibili tra consumo di frutta e verdura e lo stato cognitivo supportano generalmente un loro ruolo protettivo. Solo di recente, una maggiore adesione a una dieta mediterranea si è dimostrata associata con una diminuzione del declino cognitivo e le sindromi predemenziali, anche se essa sia combinata da diversi micro e macro-nutrienti già separatamente proposti come potenziali fattori di protezione contro la demenza. In realtà, recenti studi prospettici hanno dimostrato che una maggiore aderenza a una dieta di tipo mediterraneo potrebbe rallentare il declino cognitivo con riduzione del rischio di progressione da DCL a MA e riduzione, quindi, del rischio di MA e della mortalità per qualsiasi causa in tali malati. Questi risultati hanno suggerito che l'adesione alla dieta mediterranea può influenzare non solo il rischio di MA, ma anche di sindromi predemenziali e della loro progressione verso la demenza conclamata. Pur tuttavia, sulla base delle prove in corso su questi fattori non è possibile ancora tracciare raccomandazioni alimentari definitive. Comunque, per ridurre il rischio di disturbi cardiovascolari e metabolici dovrebbe essere incoraggiata una dieta con corretto consumo di alimenti, con un apporto moderato di vino, evitando l’aggiunta di zuccheri. È opportuno anche promuovere il consumo di pesce, di olio vegetale, di verdure non ricche d’amido, di frutta a basso indice glicemico.
In verità, dieta ed esercizio fisico possono influenzare la produzione di energia mitocondriale, importante per il mantenimento dell'eccitabilità neuronale e della funzione sinaptica. La combinazione di alcune diete e l'esercizio fisico possono avere effetti additivi sulla plasticità sinaptica e la funzione cognitiva. Peraltro, L’ATP prodotta dai mitocondri rende possibile l’attivazione del BDNF (brain-derived fattore neurotrofico) e dell’IGF1 (insulin-like growth factor 1), che sostengono la plasticità sinaptica e la funzione cognitiva. Le molecole dell’equilibrio energetico, come l’uMtCK (ubiquitous mitochondrial creatine kinase), l’AMPK (AMP-activated protein kinase) e l’UCP2 (uncoupling protein 2), interagiscono con il BDNF nel modulare la plasticità sinaptica e la cognizione. La produzione di energia in eccesso, causata da un apporto calorico elevato o come risultato di un intenso esercizio fisico, determina la formazione di ROS (reactive oxygen species). Quando i livelli di ROS superano la capacità di tamponamento della cellula la plasticità sinaptica e la funzione cognitiva sono compromesse, probabilmente a causa di una riduzione delle azioni dei modulatori di trasduzione del segnale, come il BDNF. Il metabolismo energetico può colpire anche le molecole come il SIRT1 (silent information regulator 1), una deacetilasi istonica, che contribuisce alla riduzione dei ROS e che promuove le modificazioni della cromatina alla base delle alterazioni epigenetiche che potrebbero influire sulla cognizione. A tale proposito, il gene BDNF, sulla base della sua dimostrata sensibilità per le modificazioni epigenetiche, rappresenta un potenziale bersaglio per gli effetti della dieta.
Peraltro, i circuiti neurali, coinvolti nel comportamento alimentare, mostrano un coordinamento preciso con i centri cerebrali che modulano l'omeostasi energetica e la funzione cognitiva. Gli effetti del cibo sulla cognizione e le emozioni possono iniziare prima dell'atto di nutrirsi, come il ricordo degli alimenti mediante input sensoriali olfattivi e visivi che alterano lo stato emozionale del cervello. Peraltro, l'ingestione dei cibi stimola il rilascio in circolo di ormoni o peptidi, come l'insulina e il GLP1 (glucagon-like peptide 1). Queste sostanze possono poi raggiungere centri, come l'ipotalamo e l’ippocampo, e attivare le vie di trasduzione del segnale che promuovono l'attività sinaptica, contribuendo all'apprendimento e alla memoria. A sua volta, la mancanza di cibo, segnalata da uno stomaco vuoto, può provocare il rilascio di grelina in grado anche di supportare la plasticità sinaptica e le funzioni cognitive. I messaggi chimici derivati dal tessuto adiposo possono a loro volta, attraverso la leptina, attivare i recettori specifici dell’ippocampo e dell'ipotalamo e influenzare, così, l'apprendimento e la memoria. Le azioni positive della leptina sulla plasticità sinaptica ippocampo-dipendente, vale a dire le sue azioni sulla funzione recettoriale del NMDA (N-methyl-D-aspartate) e sulla facilitazione del potenziamento a lungo termine, sono ben caratterizzate. È degno di nota che l’IGF1 (Insulin-like growth factor 1) è prodotto dal fegato e dal muscolo scheletrico in risposta ai segnali provenienti dal metabolismo e dall'esercizio. L’IGF1 può fornire segnali ai neuroni dell'ipotalamo e dell'ippocampo, producendo effetti consequenziali sull'apprendimento e sulle prestazioni della memoria. Peraltro, oltre alla regolazione dell'appetito, l'ipotalamo coordina l'attività a livello intestinale e integra la funzione viscerale con le strutture del sistema limbico, come l'ippocampo, l'amigdala e la corteccia cerebrale. Inoltre per intervento dello HPA (hypothalamic–pituitary axis) possono anche realizzarsi segnali viscerali che modulano la cognizione e la fisiologia del corpo, ma altri effetti dell'ipotalamo possono coinvolgere il sistema immunitario, dato che esso innerva abbondantemente il timo. In effetti, tutto ciò contribuisce al fatto che diverse molecole del sistema immunitario possono influenzare la plasticità sinaptica e la cognizione. L'innervazione parasimpatica dell’intestino da parte del nervo vago fornisce informazioni sensoriali al cervello, consentendo all'attività intestinale di essere in grado d’influenzare le emozioni. A loro volta, le emozioni possono anche influenzare i visceri attraverso le vie efferenti parasimpatiche del nervo vago. In effetti, è da notare che la stimolazione del nervo è stata indicata e viene anche utilizzata a scopo terapeutico nella cura della depressione cronica.
Difatti, con il termine tecnico VNS (Vagal nerve stimulation), s’indica l’azione di un semplicissimo pacemaker per la stimolazione del cervello. L'apparecchio viene impiantato direttamente nel torace del paziente e, tramite due fili che risalgono attraverso il collo, stimola il vago, centro delle principali vie di comunicazione. La sua applicazione, riservata inizialmente alla cura dell’epilessia, con il tempo ha mostrato, secondo i primi sperimentatori, benefici nei malati di depressione acuta e cronica.
Harold A. Sackeim del New York State Psychiatric Institute, referente scientifico della Cyberonics Inc., la fabbrica di Huston produttrice dello stimolatore, ha dichiarato la possibilità di trattamento a tutti quei pazienti che non hanno successo con le altre cure. Ora, comunque, si attendono maggiori e più convincenti evidenze scientifiche sui suoi effetti. Ciò nonostante, l’utilizzo di tale tecnica il 18 luglio 2005 ha ottenuto dalla Food and Drug Administration l’approvazione solo per il trattamento della Depressione Maggiore Resistente (DMR).
In definitiva, l'insorgenza di malattie neurodegenerative legate all'età, come il morbo di Alzheimer (AD) o quello di Parkinson, sovrapponendosi al declino funzionale normale del sistema nervoso, porta ad aggravare i deficit della motricità e quelli cognitivi e comportamentali della senescenza. Pertanto, i metodi di esplorazione e cura per ritardare o invertire il deficit neuronale dell’anziano sono estremamente importanti per il suo benessere. Il consumo di alimenti e nutrienti ad alto contenuto di polifenoli, in aggiunta a diete prudenziali ad alto contenuto di frutta, verdura, cereali integrali e pesce, ha, invero, dimostrato di prevenire e addirittura invertire il verificarsi di quei cambiamenti neurochimici e comportamentali che si verificano con l'invecchiamento. Al contrario, usando un tipico stile occidentale, con dieta impropria e non salutare, si aumenta il rischio del declino cognitivo e della demenza. Agenti pleiotropici, tra cui l’acido grasso omega-3 DHA (acido docosaesaenoico), la curcumina e l'esercizio fisico possono, di fatto, colpire più passaggi della cascata verso l’Alzheimer (MA), tra cui l’amiloide, gli oligomeri del tau, l'infiammazione, il danno ossidativo e la tossicità sinaptica. Comunque, gli approcci di prevenzione alla MA necessitano anche di applicazioni genetiche.
Acidi grassi e declino cognitivo
L’ARCD (Age-related cognitive decline) condiziona un deterioramento in diversi ambiti, tra cui le prestazioni della memoria, la funzione esecutiva e la velocità di elaborazione cognitiva. Le sue cause sono ancora poco chiare e le evidenze tendono a collegarlo alle malattie cardiovascolari (MCV) e ai fattori di rischio, come il diabete mellito e l’ipertensione. Pochi sono i fattori di rischio modificabili ben stabiliti per l’ARCD, ma data la sua associazione con le MCV, plausibilmente essi dovrebbero includere, con i forti ruoli ben fissati per l'eziologia della malattia cardiovascolare, gli acidi grassi alimentari.
Peraltro, l’obesità, il diabete mellito di tipo 2, l’ipercolesterolemia, l’ipertensione e le malattie cardiovascolari sono, di certo, stabiliti fattori di rischio per l’invecchiamento patologico del cervello. Fattori che sono ormai riconosciuti collegati alla resistenza insulinica sottostante con inadeguatezza della sua capacità metabolica. Queste condizioni, d’altro canto, aumentano notevolmente per effetto di un aumentato apporto calorico derivato dagli acidi grassi saturi e dai carboidrati semplici. Questo modello di dieta può, di certo, aumentare il rischio di compromissione cognitiva e della malattia di Alzheimer (MA), legato all’invecchiamento. La letteratura scientifica in questo campo è divenuta fiorente, ma complessa. Pur tuttavia, diverse rassegne epidemiologiche, anche recenti, suggerirebbero che l’aumentata assunzione di grassi saturi rappresenta un rischio per il deficit cognitivo e la MA, mentre la loro riduzione con una maggiore assunzione di grassi monoinsaturi e di polinsaturi otterrebbe un effetto protettivo.
Precedenti studi prospettici sull’assunzione di dieta con SFA (saturated fatty acid), con TFA (trans-unsaturated fatty acid) e con MUFA (mono-unsaturated fatty acid) hanno dimostrato associazioni variabili con il declino cognitivo, suggerendo, per la maggior parte, effetti deleteri per gli SFA e TFA. Pochi studi, e con non chiari riferimenti sugli effetti globali e degli elementi specifici sulla funzione cognitiva, hanno misurato, però, i singoli acidi grassi e il declino cognitivo nelle componenti della funzione cognitiva oltre lo standard del Mini-Mental State Examination.
Sulla base degli oramai consolidati rapporti, da una parte deleteri tra SFA e TFA e dall’altra vantaggiosi dei MUFA con le MCV è stato ipotizzato un comportamento simile anche nel declino cognitivo.
Bayer-Carter JL del Veterans Affairs Puget Sound Health Care System, Seattle, Washington e collaboratori hanno svolto uno studio controllato, randomizzato su quarantanove anziani, di cui 20 sani di età media [DS] di 69,3 [7,4] anni e su 29 adulti con aMCI di età media [DS] di 67,6 [6,8] anni (Arch Neurol. 2011;68(6):743-752). I partecipanti hanno ricevuto la dieta HIGH con il 45% di grassi, saturi più del 25%, con il 35% -40% di carboidrati con indice glicemico maggiore di 70 e con il 15% -20% di proteine. Il braccio LOW della dieta era composto dal 25% di grassi, saturi meno del 7%, dal 55% - 60% di carboidrati con indice glicemico minore di 55 e dal 15% -20% di proteine, per 4 settimane. Sono stati condotti test cognitivi, una prova orale di tolleranza al glucosio e la puntura lombare al basale e durante la quarta settimana della dieta. Le principali misure di outcome erano costituite dalle concentrazioni di β-amiloide nel CSF (A β 42 e A β 40), della proteina tau, dell’insulina, degli F2-isoprostani, dell’apolipoproteina E, dei lipidi plasmatici, dell’insulina e dalle misure di cognizione. Per il gruppo aMCI, la dieta LOW aumentava le concentrazioni dell’A β 42, in contrasto con il modello patologico tipicamente basso osservato nell’Alzheimer.

La stessa dieta aveva effetto opposto negli adulti sani, cioè una diminuzione dell’A β 42 CSF. La dieta HIGH, invece, aumentava l’A β 42 CSF. Per altro canto, la concentrazione di apolipoproteina E nel CSF aumentava nella dieta LOW e diminuiva nella HIGH in entrambi i gruppi. Per il gruppo aMCI la concentrazione d’insulina aumentava con la dieta LOW, mentre per gli adulti sani nella HIGH si abbassava nel CSF. Peraltro, la HIGH aumentava e la LOW diminuiva le concentrazioni plasmatiche dei lipidi, dell’insulina e del F2-isoprostano CSF. La memoria visiva ritardata migliorava in entrambi i gruppi dopo il completamento delle 4 settimane di dieta LOW. Questi risultati suggerivano agli Autori che la dieta poteva essere un potente fattore ambientale come modulatore dello stato cognitivo con i suoi effetti di rischio sul sistema nervoso centrale riguardo le concentrazioni dell’A β 42, delle lipoproteine, dello stress ossidativo e dell’insulina.
Dal loro canto Asghar Z. Naqvi dell’Harvard Medical School, Boston e collaboratori, proprio per valutare in modo prospettico gli effetti di selezionati grassi alimentari sul declino cognitivo, hanno studiato in tre anni di follow-up 482 donne del WHI (Women's Health Initiative), di età dai sessanta anni e oltre, verso un gruppo di controllo (J Am Geriatr Soc. 2011 May; 59(5): 837–843).

La dieta era desunta da un questionario di frequenza alimentare validato (FFQ) per due volte (in media 2,7 anni di distanza), con prima base di valutazione cognitiva (in media 2,9 anni dopo la seconda FFQ) di cui è stata calcolata la media. Sono state eseguite due volte a tre anni di distanza le prove di memoria, di vista, di funzione esecutiva, della lingua e dell'attenzione.
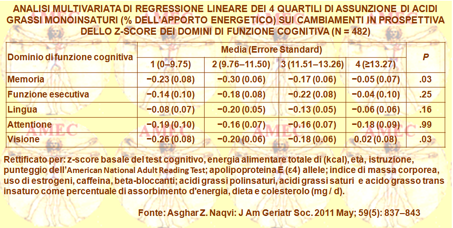
L’assunzione media di grassi saturi (SFA), trans (TFA), monoinsaturi (MUFA) e colesterolo alimentare (DC) era rispettivamente: 18,53, 3,45, 0,201 e 19,39 g / die. Non c'erano associazioni tra il grado di declino cognitivo e l'assunzione di SFA (P = .69), TFA (P = 0,54) o DC (P = 0,64) dopo aggiustamento per la cognizione di base, l'assunzione di energia totale, età, istruzione, capacità di lettura, apolipoproteina E allele ε4, indice di massa corporea, estrogeni e beta-bloccanti e assunzione di acidi grassi, caffeina o altro.
Al contrario, l'assunzione dei MUFA si associava a un minore declino cognitivo nei modelli pienamente adeguati di regressione lineare per il declino medio (errore standard) di 0,21 (0,05) nella parte più bassa e 0,05 (0,05) nei più alti quartili (P = .02). Questo effetto dei MUFA era principalmente nei domini visivi e di memoria (P = 0,03 per entrambi). In conclusione, una maggiore assunzione di SFA, TFA, e la DC non era associata a declino cognitivo, mentre una maggiore presenza di MUFA negli alimenti si associava con un declino cognitivo minore.
Grassi alimentari e aggressività
Peraltro, Beatrice A. Golomb dell’University of California - San Diego e collaboratori, sulla base degli studi che dimostravano l’associazione tra acidi grassi omega-3 con la maggiore amabilità e la ridotta impulsività, considerando anche l’influenza negativa dei grassi trans a produrre acidi omega-3 a catena lunga, favorevoli per il cervello, hanno compiuto uno studio trasversale su 945 adulti di età media di cinquantasette anni, con range dai quarantacinque ai sessantanove anni, nel 68% di sesso maschile e nell'80% bianchi, con consumo medio di grassi trans di 3,49/die grammi (range 1,02 - 5,96 g / die), per ottenere informazioni di base della dieta sulle valutazioni comportamentali e per analizzare, così, la relazione tra assunzione di acidi grassi trans e irritabilità o aggressività (PLoS ONE 2012, 7(3): e32175).
I partecipanti, visti tra il 1999 e il 2004, non usavano farmaci ipolipemizzanti ed erano senza un aumento dei livelli ematici delle lipoproteine a bassa densità (LDL). Erano, peraltro, esenti da diabete, HIV, cancro o malattie cardiache.
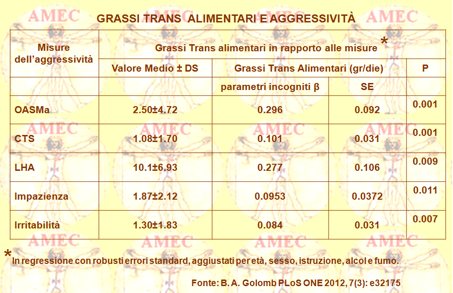
I ricercatori hanno, così, raccolto i dati dei nutrienti mediante un questionario di frequenza alimentare, hanno raccolto le informazioni sugli atti comportamentali di aggressione verso di sé, gli altri e gli oggetti, con una varietà di strumenti validati, tra cui l’OASMa sottoscala (Overt Aggression Scale Modified – Aggression subscale), la LHA (Life History of Aggression), la CTS (Conflict Tactics Scale) e l'insofferenza, l’irritabilità. I partecipanti che mangiavano più grassi trans riscuotevano punteggi più alti su ciascuna di queste misure. Ciò emergeva sia per gli uomini sia per le donne, ma anche nei vari gruppi d’età, ossia tra le persone sotto i quaranta anni, dai quaranta ai sessanta e oltre i sessanta anni e così pure per i caucasici e le minoranze. Questo studio, secondo gli Autori, porterebbe altro supporto alla raccomandazione del limitato consumo di grassi trans, già ampiamente condiviso per evitare malattie cardiache e alcuni tipi di cancro.
Nutrienti, funzione cognitiva e volume cerebrale
G.L. Bowman dell’University of Portland e collaboratori, per esaminare il rapporto tra stato nutrizionale e indici psicometrici e d’imaging cerebrale negli anziani senza demenza hanno analizzato trenta biomarcatori plasmatici della dieta nella coorte di 104 soggetti, di età media di 87 + 10 anni nel 62% donne, dell’Oregon Brain Aging Study (Neurology 2012;78:241–249). I principali componenti delle analisi, costruite sui NBPs (nutrient biomarker patterns) e i modelli di regressione, valutavano la relazione degli stessi con gli esiti cognitivi e con la risonanza magnetica.
Due NBP erano associati a misure cognitive più favorevoli e ad alte misure della risonanza magnetica: una ad alto contenuto di vitamine plasmatiche del gruppo B (B1, B2, B6, folati e B12), C, D, ed E; l’altra ad alto contenuto di acidi grassi marini ω-3 plasmatici. Un terzo modello era caratterizzato da alto contenuto di grassi trans ed era associato con funzioni cognitive meno favorevoli e a minore volume totale cerebrale. La depressione attenuava il rapporto tra il modello degli ω-3 marini e il volume d’iperintensità della sostanza bianca. In conclusione, distinti modelli di biomarcatori di nutrienti rilevati nel plasma potevano essere interpretati e rendere conto di un grado significativo di varianza sia per le funzioni cognitive sia per il volume del cervello.
Biomarker predittivo del declino cognitivo lo spessore corticale alla MRI negli adulti normali
Dickerson BC dell’Harvard Medical School, Boston e collaboratori, proprio in considerazione dei recenti criteri diagnostici sviluppati nella fase preclinica della malattia di Alzheimer (MA) con l’utilizzo di biomarcatori in adulti cognitivamente normali (CN), hanno utilizzato la MRI per implementarli (Neurology. 2012 Jan 10;78(2):84-90). Hanno, così, fatto riscontro presso l’Alzheimer's Disease Neuroimaging Initiative per gli individui CN. Per lo studio, i ricercatori hanno impiegato scansioni del cervello per misurare lo spessore delle regioni della corteccia cerebrale in 159 persone libere da demenza, di un'età media di settantasei anni. Le regioni del cervello sono state scelte sulla base degli studi precedenti che dimostravano un restringimento nei pazienti di Alzheimer. Delle 159 persone, a causa di minori dimensioni di particolari regioni note per essere vulnerabili al morbo, diciannove sono state classificate come ad alto rischio di avere una malattia, 116 a medio e ventiquattro a basso. All'inizio dello studio e nei tre anni successivi i partecipanti sono stati sottoposti a test che misuravano la memoria, il problem solving e la capacità di pianificare e prestare attenzione, utilizzando il cambiamento nella somma del Clinical Dementia Rating e delle misure neuropsicologiche selezionate.
Gli individui ad alto rischio di MA preclinica erano più tendenti a sperimentare il declino cognitivo che si sviluppava nel 21% rispetto al 7% del gruppo a medio e allo 0% di quello a basso rischio (p = 0,03). La regressione logistica dimostrava che per ogni unità di DS di assottigliamento corticale si associava un rischio quasi triplicato del declino cognitivo (p = 0,02). Peraltro, tra coloro per i quali erano disponibili i dati al basale del CSF, il 60% del gruppo più a rischio per la malattia precoce di Alzheimer aveva caratteristiche CSF (cerebrospinal fluid) coerenti con la malattia con livelli anormali di proteine, mentre solo il 36% del gruppo a rischio medio e il 19% di quelli a basso rischio avevano queste caratteristiche (p = 0,1).












.png)





