NOTIZIARIO Ottobre 2014 N°9
ECCESSO DI PESO E RISCHIO DI TUMORI MALIGNI DELL’APPARATO DIGESTIVO
A cura di:
Giuseppe Di Lascio §
Con la collaborazione di:
Sostanziale l’aumento del rischio di cancro con l’eccesso di peso
È ormai abbastanza noto che il peso corporeo gioca un ruolo importante nel rischio di alcuni tipi di cancro. Pur tuttavia, il rapporto per i diversi tipi di cancro tra l’eccesso di peso e la malattia neoplastica può mostrare variazione dei suoi effetti.
A tal proposito, Krishnan Bhaskaran della London School of Hygiene and Tropical Medicine, UK e collaboratori hanno voluto svolgere un’indagine sui legami tra BMI e i tumori specifici per le sede più comuni (The Lancet, Volume 384, Issue 9945, Pages 755 - 765, 30 August 2014).

Con i dati dei soggetti delle cure primarie del Clinical Practice Research Datalink provvisti dei valori della BMI, gli Autori hanno formato modelli di Cox per indagare le associazioni in ventidue dei tumori più comuni con aggiustamento per i potenziali fattori confondenti. In 5.243.978 individui inclusi, 166.955 sviluppavano tumori. La BMI si associava a diciassette dei ventidue tipi di cancro, ma gli effetti variavano notevolmente in base alla sede.
Ogni 5 kg / m2 di aumento della BMI si registrava una crescita, più o meno lineare, dei tumori dell'utero (hazard ratio [HR] 1 · 62, IC 99%= 1 · 56-1 · 69, p <0 · 0001), della colecisti (1 · 31,1 · 12-1 · 52; p <0 · 0001), del rene (1 · 25,1 · 17-1 · 33; p <0 · 0001), della cervice (1 · 10,1 · 03-1 · 17; p = 0 · 00035), della tiroide (1 · 09,1 · 00-1 · 19; p = 0 · 0088) e la leucemia (1 · 09,1 · 05-1 · 13; p≤0 · 0001).
La BMI era associata positivamente anche con p <0·0001 con il cancro del fegato (1· 19,1 · 12-1 · 27), del colon (1 · 10,1 · 07-1 · 13), dell'ovaio (1 · 09, 1,04-1,14), e complessivamente del seno in postmenopausa (1 · 05, 1 · 03-1 · 07). Questi effetti, però, variavano in rapporto alle caratteristiche sottostanti della BMI o a livello individuale.
Gli Autori rilevavano, inoltre, associazioni inverse con il rischio del cancro alla prostata e al seno in premenopausa, sia nel complesso (prostata · 098, 0· 95-1 · 00; premenopausa cancro al seno · 089, 0· 86-0 · 92) sia nei non fumatori (prostata · 0,96, 0· 93-0 · 99; premenopausa cancro al seno · 089, 0· 85-0 · 94).

Al contrario, per il polmone e per il cancro della cavità orale gli Autori in chi non aveva mai fumato non riscontravano alcuna associazione (polmone 099, 0 · 93-1 · 05; cavità orale 1 · 07, 0 · 91-1 · 26). Associazioni generali inverse erano presenti negli ex-fumatori e negli attuali, probabilmente a causa del confondimento residuo del fumo.
In conformità a tali dati, gli Autori supponevano che si sarebbe potuto attribuire la causalità dell’eccesso di peso al 41% dei cancri dell’utero e a più del 10% di quelli della cistifellea, dei reni, del fegato e del colon.
Secondo una loro stima un 1 kg / m2 di aumento del livello del BMI nella popolazione si sarebbe dovuto tradurre in aggiuntivi 3.790 pazienti annuali britannici con uno dei dieci tumori positivamente associati all’eccesso di peso.
In conclusione, la BMI era associata, con notevoli ripercussioni a livello comunitario, al rischio del cancro. Peraltro, l'eterogeneità negli effetti suggeriva che ai diversi siti e ai sottogruppi dei pazienti erano associati differenti meccanismi.
Obesità viscerale e rischio dell'esofago di BARRETT
Le persone in sovrappeso e obese presentano una probabilità circa due volte maggiore di quelle di peso normale nello sviluppo di un dell’adenocarcinoma esofageo. Invece, nessun aumento del rischio o addirittura un calo, si è osservato per l'altro tipo principale di cancro esofageo, il carcinoma a cellule squamose.
I meccanismi attraverso i quali l'obesità può aumentare il rischio di adenocarcinoma esofageo non sono ben compresi. Tuttavia, le persone in sovrappeso e obese hanno maggiori probabilità, rispetto alle persone di peso normale, di una storia di malattia da reflusso gastroesofageo o di esofago di Barrett, condizioni patologiche, invero, associate a un aumentato rischio di adenocarcinoma esofageo. È possibile, peraltro, che l'obesità determini un aggravamento dell'infiammazione esofagea associata con queste condizioni.
Wiseman EF e Ang YS della Royal Albert Edward Infirmary, Wigan Lane, Manchester, United Kingdom in una loro revisione hanno ribadito, con la patogenesi che sembra progredire attraverso una sequenza MDC (metaplasia-dysplasia-carcinoma), il dato relativo all’esofago di Barrett (BE) nel conferimento di un significativo aumento del rischio di sviluppo di adenocarcinoma esofageo (EAC). Diversi insulti genetici sono alla guida di questa sequenza e sono anche stati recentemente caratterizzati, fornendo obiettivi per i biomarcatori candidati a una potenziale utilità clinica per stratificare il rischio nei singoli pazienti. Sono stati indagati anche molti fattori clinici di rischio, di tipo genetico e gastrointestinale. Gli Autori nella loro revisione hanno riassunto le attuali conoscenze sui meccanismi coinvolti nella progressione neoplastica del BE sino all’EAC e hanno valutato criticamente i relativi ruoli e i contributi dei fattori di rischio putativi attualmente disponibili (World J Gastroenterol. 2011 Aug 28;17(32):3672-83.).
Dal loro canto, Murray L e Romero Y. della Queen's University of Belfast, UK, considerando l’associazione nel mondo occidentale dell’aumento drammatico negli ultimi anni dell'incidenza dell’adenocarcinoma esofageo (EAC), dell’esofago di Barrett e della malattia da reflusso gastroesofageo con la crescita epidemica dell’obesità, hanno voluto concentrare il loro interesse sul possibile ruolo di fattore di rischio da parte di quest’ultima per EAC e per i suoi precursori (Surg Oncol Clin N Am. 2009 Jul;18(3):439-52). Gli Autori hanno, così, esaminato le correnti evidenze sul ruolo del sovrappeso / obesità e della distribuzione del grasso corporeo nei confronti dello sviluppo della sequenza esofagite-metaplasia-displasia-adenocarcinoma. Particolare attenzione hanno rivolto alla fase in cui l’adiposità può agire nell’influenzare il rischio di EAC, poiché questo determina per la prevenzione dell’EAC l'importanza in ogni fase nello spettro delle malattie del controllo del peso e della sua perdita.
Akiyama T del Tokyo Metropolitan Hiroo Hospital, Japan e collaboratori hanno considerato, invece, la controversia ancora esistente sul dato che l'obesità semplice, misurata dall'indice di massa corporea (BMI), possa costituire un fattore di rischio indipendente per l'esofago di Barrett (BE). Gli Autori hanno anche rilevato i risultati dei precedenti studi che avevano indicato come l'obesità addominale, definita dalla circonferenza della vita (WC) e dal rapporto vita-fianchi (WHR), potesse essere un fattore di rischio per il BE, indipendentemente dalla BMI. Pur tuttavia, l'associazione tra BMI e BE non era stata più osservata dopo aggiustamento per il WC e il WHR. Inoltre, l’obesità viscerale, come direttamente misurata sulle immagini della TC addominale, era stata segnalata per avere anche un’associazione con il rischio di BE. Oltre agli effetti meccanici dell’obesità addominale, cioè dell’aumento della pressione intraddominale derivato dalla grande quantità del tessuto adiposo, i fattori secreti circolanti dell’IVA (intra-abdominal visceral fat), come il fattore di necrosi tumorale-α, l’interleuchina-6, la leptina e l’adiponectina, sono stati anche proposti come fattori patogeneticamente collegati al BE e all’adenocarcinoma esofageo.
In effetti, l'obesità è associata con il rischio di BE che sembra essere mediato per la maggior parte dall’obesità addominale, soprattutto quella viscerale. Ciò solleva, in effetti, alcuni quesiti riguardanti la correlazione della patogenesi del BE con l’obesità (Digestion. 2011;83(3):142-5).
Obesità e cancro gastrointestinale
In Italia si contano poco più di 69.000 persone, nel 55% maschi e nel 45% femmine, affette da carcinoma gastrico, corrispondenti al 3,1% del totale dei pazienti oncologici. Nel 2013 sono stati diagnosticati circa 13.200 nuovi casi della malattia, attualmente al quinto posto in ordine d’incidenza tra gli uomini e al sesto tra le donne, corrispondendo al 5% di tutti i tumori nei maschi e al 3% nelle femmine. La mortalità è corrisposta a quasi 10.000 decessi con il 58% nei maschi. La sopravvivenza a cinque anni per i casi insorti nel 2005-2007 si è confermata bassa con il 34% nei maschi e il 36% nelle femmine, ma con modesto aumento rispetto ai periodi precedenti.
Da ricordare che l’HP (Helicobacter pylori) può indurre la gastrite cronica e che l’infezione rappresenta il principale fattore di rischio per il carcinoma dello stomaco.
Peraltro, stili di vita errati, come l’abitudine al fumo, il basso consumo di frutta e verdura, l’eccessiva alimentazione di carni rosse, il consumo di cibi conservati con sale e/o affumicati sono ritenuti anche pregiudizievoli per l’insorgenza della malattia.
Anche la tilosi, condizione molto rara dovuta a un'aberrazione genetica, è comunemente associata con il cancro esofageo. In questa malattia si riscontra anche un’ipercheratosi delle palme e delle piante dei piedi.
Yang P della Sichuan University, China e collaboratori, volendo studiare la relazione tra l’eccesso del peso corporeo e il rischio del cancro gastrico, hanno condotto una revisione sistematica e una metanalisi degli studi di coorte pubblicati nei meriti dal 1950 in poi (Eur J Cancer. 2009 Nov;45(16):2867-73.).
Gli Autori hanno, così, identificato dieci studi per un numero totale di 9.492 casi di cancro gastrico su una popolazione di studio di 3.097.794 individui.
Nel complesso, il peso corporeo in eccesso, definito dall’indice di massa corporea (BMI), si associava a un aumentato rischio della neoplasia maligna [odds ratio (OR) = 1.22; Intervalli di confidenza (IC) 95% = 1,06-1,41]. In particolare, un'analisi stratificata mostrava che il peso corporeo in eccesso era associato a un aumentato rischio del cancro cardiale [OR degli individui in sovrappeso e obesi (BMI> 25), = 1.55, IC 95% = 1,31-1,84] e gastrico tra i non asiatici (OR degli individui in sovrappeso e obesi, = 1.24, IC 95% = 1,14-1,36). Tuttavia, l'analisi stratificata dimostrava che non vi era alcun nesso statisticamente significativo tra l’eccesso del peso corporeo e il cancro gastrico nei seguenti sottogruppi:
- maschi (OR degli individui in sovrappeso e obesi, = 1.22, IC 95% = 0,96-1,55), femmine (OR individui in sovrappeso e obese, = 1.13, IC 95% = 0,65-1,94),
- cancro gastrico non-cardiale (OR soggetti in sovrappeso e obesi, = 1,18, IC 95% = 0,96-1,45),
- asiatici (OR individui in sovrappeso e obesi= 1.17, 95% IC = 0,88-1,56).
In definitiva, i risultati combinati di questa metanalisi indicavano che il sovrappeso e l'obesità erano associati a un aumentato rischio del cancro gastrico. La forza dell'associazione aumentava anche con l'aumentare dei livelli della BMI.
Dal loro canto, Donohoe CL del St James' Hospital, Dublin, Ireland e collaboratori, sulla base delle emergenti evidenze della forte associazione tra obesità e cancro gastrointestinale, hanno compiuto una recensione di tipo epidemiologico e fisiopatologico nei meriti (Br J Surg. 2010; 97(5):628-42).
I numerosi studi epidemiologici selezionati riconoscevano, invero, negli obesi un aumento del rischio dell’adenocarcinoma esofageo e del colon-retto, mentre lo stesso per le altre neoplasie gastrointestinali risultava meno robusto. Il sesso, peraltro, sembrava avere un ruolo importante. I putativi meccanismi fisiopatologici di collegamento includevano il fattore di crescita insulino-simile, le adipocitochine e gli steroidi sessuali.
In conclusione, gli Autori dallo studio traevano il suggerimento di migliorare la comprensione dei meccanismi di legame tra le due patologie per scoprire i bersagli d'intervento.
Inoltre, lo stesso Autore e collaboratori, considerando, quindi, l’asse dell’IGF (insulin-like growth factor) 1 un importante mediatore nell’associazione tra l’obesità e il cancro, hanno esaminato in seguito la sua relazione e quella del suo recettore (IGF-1R) nell’adenocarcinoma esofageo, anch’esso fortemente legato all'obesità. Gli Autori hanno, così, selezionato un totale di 220 pazienti in cui i livelli di IGF-1 totale e libero risultavano significativamente aumentati nel siero dei pazienti con obesità viscerale (Br J Surg. 2012 Mar;99(3):387-96. doi: 10.1002). Le analisi d’espressione genica nei tumori rivelavano una significativa associazione tra lo stato di obesità sia con il IGF-1R (P = 0,021) sia con il IGF-1 (P = 0.031). Peraltro, l’analisi TMA (tissue microarrays) nei tumori resecati dimostrava che l’espressione dell'IGF-1R era significativamente più alta nei pazienti con obesità viscerale, rispetto a quelli di peso normale (p = 0.023). La sopravvivenza per specifica malattia era, inoltre, più lunga nei pazienti con negativizzazione dell’espressione dell’IGF-1R, rispetto a quelli con positività IGF-1R (media 60,0 contro i 23,4 mesi, p = 0,027).
In conclusione, lo studio evidenziava l'associazione tra l'asse IGF con obesità viscerale e un potenziale impatto sulla biologia dell’adenocarcinoma esofageo attraverso il suo recettore.
Obesità e rischio di cancro colorettale
Il CRC (Colorectal Cancer) con oltre 600.000 di morti ogni anno è la quarta causa di mortalità cancro-correlata in tutto il mondo. Nei quaranta Paesi europei le stime nel 2008 l’hanno indicato come il tumore più comune con 436.000 casi, pari al 13,6% del totale, e la seconda causa di morte per tumore più comune con 212.000 decessi, pari al 12,3% del totale.
I Registri Tumori in Italia indicano nel quadriennio 1998-2002 un’incidenza in aumento con un totale di circa 32.000 nuovi casi per anno con 16.000 decessi. In tal modo, la malattia si configura con l’11.5% come la terza causa di cancro femminile e con l’11.3% come la quarta di quello maschile. Il rischio di sviluppare la malattia, e comunque di morire per essa, aumenta con l’età. Infatti, è nel periodo di vita superiore ai cinquanta anni che si registra l’80% dei casi.
Rappresenta, inoltre, la seconda causa di mortalità per tumore per entrambi i sessi, rispettivamente con il 12.4% e il 10.4%. L’incidenza, però, varia a seconda delle regioni da un minimo di ventisei casi per 100.000 abitanti/anno a un massimo di cinquantatré, essendo i tassi più elevati nel settentrione. Pur tuttavia, la sopravvivenza con il 58% a cinque anni ha dimostrato una mortalità in diminuzione.
Recenti analisi sul genoma dei tumori solidi, tra cui il CRC, hanno dimostrato mutazioni tra 20 e 100 geni che codificano proteine. È stato, così, identificato nel CRC un certo numero di alterazioni chiave genetiche ed epigenetiche che portano alla trasformazione maligna. Queste includono aberrazioni in geni coinvolti nei percorsi del CIS (chromosomal instability), del MSI (microsatellite instability), del hMYH (human MutY homolog) e della metilazione dell'isola CpG (anche denominato CG con p che indica un legame fosfodiesterico che collega la C e la G).
In definitiva, il CRC in entrambi i sessi è uno dei tumori più comuni nel mondo occidentale. È il terzo tipo di tumore con oltre un milione di casi l’anno e gli ultimi decenni hanno stabilito un suo rapido aumento anche nei paesi in via di sviluppo, soprattutto nelle grandi città, dove si sono verificati i più significativi cambiamenti dello stile di vita. La stima di sopravvivenza a cinque anni, in media del 55%, è altamente variabile, dipendendo dallo stadio della malattia.
Nell’80% dei casi il cancro del colon retto è radicalmente operabile e il 35% dei pazienti presenta una recidiva dopo l’intervento nello 80% dei casi nei primi 2-3 anni, ma solitamente entro i primi cinque anni.
Diversi studi hanno, in effetti, segnalato che i fattori comportamentali, come il fumo, l'obesità, l'inattività fisica e la dieta ricca di grassi e povera di fibre possono contribuire all’eziologia di questo tipo di cancro. In particolare, la prevalenza della malattia è anche in diretta correlazione con l’aumento drammatico del sovrappeso e dell'obesità in tutto il mondo, il che pone dei precisi e importanti indirizzi di prevenzione. In effetti, la relazione tra l’eccesso ponderale e il rischio del cancro al colon è stata valutata in un gran numero di studi e documenti di revisione, ma con ampie variazioni.
Le recensioni hanno indicato che l'obesità è associata con il sette fino al 60% del maggior rischio rispetto agli individui di peso normale.
Tuttavia, i meccanismi che potrebbero essere alla base dell'associazione rimangono ancora non del tutto chiariti e diverse possibilità sono state ipotizzate.
I fattori più studiati sono i due sistemi ormonali: l’asse insulina / IGF (insulin-like growth factor) e le adipochine adiponectina e leptina. Il coinvolgimento dell’insulina e dell’IGF - 1 è stato supportato da studi sperimentali e clinici. Le ragioni plausibili principali risiedono nell'aumento dell’IGF -I libero con i cambiamenti concomitanti dell'ambiente mitogenetico e dell’anti- apoptosi cellulare che favorisce la formazione del tumore. Inoltre, è da notare che il diabete di tipo 2 aumenta il rischio di sviluppare il cancro al colon. Infine, secondo diversi studi, il grasso può anche influenzare il rischio della malattia in quanto gli adipociti e i preadipociti possono promuovere la proliferazione delle cellule neoplastiche. In effetti, la sovra espressione del complesso dell'acido grasso sintasi ha dimostrato di associarsi con il fenotipo del cancro del colon.
Per loro conto, le adipochine, come l’adiponectina e la leptina, sono anche associate con il rischio della malattia. L’adiponectina, in particolare, come agente insulinosensibilizzanti e regolatore negativo dell’angiogenesi, è secreta principalmente dal tessuto adiposo viscerale. Essa potrebbe inibire la crescita tumorale in modelli animali e in studi clinici le sue concentrazioni circolanti si associano al rischio della neoplasia. La leptina, dal suo canto, negli esperimenti in vivo e in vitro sembra anche favorire la crescita neoplastica come ormone pleiotropico nei vari sistemi cellulari con azione mitogenica, anti - apoptotica, pro - angiogenica e proinfiammatoria. In effetti, il rapporto tra le concentrazioni circolanti di leptina e il rischio di cancro al colon è ormai stato dimostrato e consequenzialmente è stata verificata anche l'associazione con l’obesità.
Pur tuttavia, a riguardo stanno emergendo altri fattori biologici, come il microbiota intestinale e gli acidi biliari.
L’alimentazione, comunque, ha da qualche tempo rivestito un importante riconosciuto ruolo nell’insorgenza del cancro del colon, ribadendo la potenzialità preventiva del maggiore consumo di frutta e verdure e quella negativa di quello delle carni, soprattutto rosse ed elaborate.
In particolare, Mauro Maccarrone della Biomedical University, Rome - Italy e collaboratori hanno di recente chiarito il ruolo dell’olio extravergine d’oliva come protettivo contro il cancro del colon (Journal of Nutritional Biochemistry). Questo prezioso alimento, caratteristico della dieta mediterranea, già ritenuto importante per ridurre l'incidenza di numerose neoplasie, sarebbe, secondo gli studi degli Autori, in grado di aumentare l’espressione del gene oncosoppressore CNR1. Quest’ultimo, a sua volta, esprimerebbe un recettore molto importante per la salute del nostro organismo, perché è in grado di regolare i meccanismi all'origine delle alterazioni dei geni sensibili ai fattori ambientali, come la dieta.
D’altro canto, l’alimentazione ricca di carni rosse e soprattutto processate e anche essiccate all’aria e in particolare il consumo di manzo è ormai un riconosciuto fattore di rischio del cancro del colon, aumentandone le probabilità del 20-30%. In effetti, gli studi epidemiologici rilevano suoi tassi elevati di prevalenza soprattutto nei Paesi a largo consumo delle carni rosse, come avviene nella maggior parte delle nazioni europee, nell’Argentina, negli Usa, nell’Uruguay e nella Nuova Zelanda. Nei paesi con una virtuale assenza di carne nella dieta, come l’India, o come diversi paesi arabi in cui v’è preferenza per scelte come l’agnello o il capretto, i tassi di cancro del colon-retto sono, invece, bassi. In Cina, dove il consumo di carne di maiale ha una lunga tradizione, i tassi della malattia sono, peraltro, intermedi. In Giappone e in Corea, dove le importazioni di carni bovine e suine hanno assunto scala di grandi dimensioni dopo la seconda guerra mondiale o dopo quella di Corea, si è osservato un forte aumento d’incidenza del cancro del colon-retto dopo il 1970 nel primo Paese e del 1990 nel secondo. In effetti, il consumo di carne poco cotta, come nel caso dello shabu-shabu, sukiyaki, sashimi di manzo crudo giapponese e dello yukhoe coreano, sorta di tartare di carne cruda, è diventato molto popolare in entrambi i paesi.
La Mongolia, in modo particolare, si annovera tra le nazioni a più bassa incidenza del tumore del colon, pur caratterizzata da un elevato consumo di carne rossa, essiccata o alla brace. Però, le carni più consumate in questo paese sono per il 50% lo yak, bovino molto diverso geneticamente da quelli del mondo occidentale, le carni ovine, di cammello e di cavallo.
Anche la carne essiccata, come il manzo di Kobe, il Biltong, la bresaola, può essere una fonte d’infezioni virali. Pur tuttavia, soprattutto la carne cruda o cotta al sangue va considerata attentamente. Nel caso di quest’ultima, le temperature al centro si aggirano sui 40-50 gradi e non superano mai i 50-70, così che molti agenti infettivi possono sopravvivere e procurare danno.
D’altro canto, nell’uomo il 21% di tutti i tumori è correlabile a qualche forma di malattia infettiva.
In particolare, circa il 35% è causato da un’infezione batterica, come nel caso dell’Helicobacter pylori, e ben i 2/3 ad un’infezione virale.
I virus dell’epatite B e C sono, difatti, causa dell’epatocarcinoma, l’HPV del cancro della cervice e dei tumori testa-collo. Peraltro, anche le infezioni da HIV 1 e 2, da virus di Epstein Barr e dall’Herpes virus sono alla base di carcinogenesi.
Circa l’1% dei tumori è, infine, attribuibile a una parassitosi, come nella schistosomiasi.
Tali relazioni causali, com’è noto, hanno determinato, peraltro, importanti ed efficaci conseguenze in sanità pubblica con la preparazione di vaccini preventivi.
Bisogna considerare anche al riguardo che durante la cottura e il processamento delle carni rosse si generano dei cancerogeni chimici. Sta di fatto che nelle feci di chi segue una dieta ricca di carne si riscontrano grandi quantità di nitroso-tioli e di nitroso-eme a spiegazione di una potenzialità cancerogena. Le carni bianche, invece, sono sicure o meglio protettive, anche quando fritte, grigliate o affumicate.
Infine, è anche interessante annotare che diversi studi epidemiologici hanno segnalato un aumentato rischio di cancro dell’orofaringe e del polmone tra i macellai e gli addetti alle operazioni dei mattatoi, operatori regolarmente esposte agli aerosol originatisi dalla lavorazione delle carcasse degli animali. In questo caso potrebbe trattarsi di un agente infettivo trasmesso per via aerea.
A tale riguardo è interessante annotare che zur Hausen H della Deutsches Krebsforschungszentrum, Germany e premio Nobel per la fisiologia e la medicina nel 2008, basandosi su quanto esposto e sui dati disponibili, ha suggerito la compatibilità con l'interpretazione che uno o più virus bovini, termoresistenti, potenzialmente oncogeni potrebbero rappresentare il fattore oncogeno specifico della carne di manzo (Int J Cancer. 2012 Jun 1;130(11):2475-83). Questi agenti, potrebbero, di fatto, contaminare le preparazioni della carne bovina e portare a infezioni latenti nel tratto colorettale. L’esposizione concomitante o successiva ad agenti cancerogeni chimici, derivanti dalle procedure di cottura, dovrebbe, inoltre, portare a un aumento del rischio di cancro del colon-retto, sinergica con queste infezioni.
In effetti, l’Autore ha basato questa sua ipotesi sul dato della segnalazione costante dell’aumento del rischio di cancro del colon-retto in associazione con il consumo di lunga data della carne rossa cotta e trasformata, attribuendone spesso la causa agli agenti cancerogeni chimici derivanti durante il processo di cottura della carne.
Peraltro, secondo l’Autore, questa patogenesi oncogena potrebbe interessare anche altre neoplasie comuni nel mondo occidentale, come quella della mammella e del polmone nei non fumatori.
In definitiva, comunque, vi sono ormai evidenze che una BMI più elevata negli uomini risulta fortemente associata con un aumentato rischio di cancro colorettale. Peraltro, anche la distribuzione del grasso corporeo sembra essere un fattore importante. Difatti, l'obesità addominale, che può essere misurata con la circonferenza della vita, mostrerebbe la più forte associazione con il rischio della malattia. Anche nelle donne è stata documentata l'associazione tra la BMI e la circonferenza della vita, ma in tono più debole. Peraltro, l'uso della MHT (menopausal hormone therapy) può modificare tale l'associazione nelle donne in postmenopausa.
L’alta BMI è anche associata a rischio di cancro del retto, ma con un aumento più modesto.
Alireza Ansary Moghaddam del George Institute for International Health, Sydney e collaboratori hanno identificato gli studi più rilevanti riguardanti l'associazione tra obesità generale, definita come indice di massa corporea (BMI) ≥ 30 kg/m2 e obesità centrale misurata con la circonferenza vita, con il cancro del colon-retto (Cancer Epidemiol Biomarkers Prev 2007;16(12):2533–47). Hanno, così, selezionato alcune meta-analisi, coinvolgenti 70.000 casi di cancro del colon-retto di trentuno studi, di cui ventitré di coorte e otto di caso-controllo. Dopo l’unificazione dei dati e la correzione per i bias di pubblicazione, il rischio stimato relativo di tumore era 1,19 [intervallo di confidenza al 95% (IC 95%), 1,11-1,29] nel confronto tra obesi (BMI ≥ 30 kg/m2) e quelli di peso normale (BMI <25 kg/m2). Era, invece, 1,45 (IC 95%, 1,31-1,61) quando erano messi a confronto quelli con il più alto verso il più basso livello di obesità centrale. Dopo la correzione per i bias di pubblicazione, il rischio di cancro del colon-retto era 1.41 (IC 95%, 1,30-1,54) negli uomini, rispetto a 1,08 (IC 95%, 0,98-1,18) per le donne (Pheterogeneity <0.001). C'era la prova di una relazione dose-risposta tra BMI e cancro del colon-retto: per un aumento di 2 kg/m2 della BMI il rischio di cancro aumentava del 7% (4-10%). Per un aumento di 2 cm di circonferenza vita il rischio aumentava del 4% (2-5%).
In conclusione, sulla base dei dati acquisiti gli Autori affermavano che l’obesità aveva un rapporto diretto e indipendente con il cancro del colon-retto, anche se la forza dell'associazione con l'obesità in generale era più piccola di quanto prima riportato.
Per loro conto, Sung MK e Bae YJ dell’University di Seoul, South Korea ribadendo che la dieta è uno dei fattori ambientali di maggiore effetto nello sviluppo del cancro ma che a causa della sua complessa natura era molto difficile fornire spiegazioni chiare sul ruolo dei componenti nella carcinogenesi, hanno analizzato l’insieme dei trascritti dei geni, delle proteine e dei metaboliti per identificare le molecole coinvolte nello sviluppo della malattia (Biotechnol J. 2010 Sep;5(9):930-41). Tutto ciò derivava anche in ragione della disponibilità delle nuove tecniche di studio. In effetti, la boinformatica utilizza i dati per eseguire le analisi di rete e suggerire le possibili interazioni tra i processi metabolici e i fattori ambientali. L'obesità è, comunque, riconosciuta come uno dei fattori di rischio più strettamente correlati al tumore del colon-retto (CRC). Vari disturbi metabolici derivati dal bilancio energetico positivo possono, invero, innescare e accelerare lo sviluppo del CRC. Gli Autori nella loro recensione hanno riassunto i rapporti dei geni, delle proteine e dei metaboliti legati all’obesità o al CRC. Hanno, quindi, suggerito le molecole candidate alla correlazione tra l'obesità e il CRC come quanto riportato dalla letteratura disponibile. Hanno anche suggerito la possibile applicazione della bioinformatica per una larga scala di analisi di rete nello studio del rapporto di causa - effetto tra i componenti della dieta e il CRC.
Renehan AG dell’University of Manchester, United Kingdom e collaboratori, per un’informazione politica di sanità pubblica e per guidare ulteriori ricerche, hanno valutato anche l'onere d’incidenza del cancro colorettale in rapporto all’eccesso della body mass index (BMI maggiore o uguale a 25 kg / m 2 ) di trenta paesi europei (Int J Cancer. 2010 Feb 1;126(3):692-702). I numeri specifici per paese dei nuovi casi di tumore erano ricavati dal Globocan 2002. Nel 2002 si registravano 2.171.351 nuove diagnosi di cancro nei trenta paesi presi in esame, di cui il 65% era rappresentato da quelli dell'endometrio, della mammella in post-menopausa e dai colorettali.
Nel 2006, si rilevavano 412.900 diagnosti di nuovi casi di cancro del colon retto con una stima attribuibile di rischio personale del 10,92% (95% IC 9,59% al 12,24%) negli uomini e 2,57% (IC 95% 0% al 5,51% ) nelle donne per il cancro del colon e di 5,05% (IC 95% 3,45% al 6,67%) per il tumore del retto negli uomini, corrispondente a 15,844 casi di carco colon retto in eccesso (IC 95% 11,304-20,735).
Quest’analisi quantificava l'onere dei casi di cancro attribuibili all’eccesso della BMI in Europa. Le stime riportate fornivano una base per modelli di studio futuri e ponevano l’accento sulla necessità di una ricerca sugli interventi per il controllo del peso nel contesto della patologia neoplastica del colon-retto, dell'endometrio e della mammella.
Ida Laake dell’University of Oslo, Norway e collaboratori, volendo chiarire l’influenza del cambiamento di peso sul rischio del cancro del colon, hanno compiuto un grande studio di coorte sulla popolazione norvegese (Cancer Epidemiol Biomarkers Prev June 2010 19; 1511).
Gli Autori hanno, quindi, controllato il peso di 38.822 uomini e 37.357 donne tra il 1974 e il 1988, misurando il loro peso fino a tre volte. Gli hazard ratio (HR) e gli intervalli di confidenza (IC) erano stimati utilizzando la regressione di Cox.
Durante il follow-up erano identificati 228 casi di tumore del colon prossimali e 174 distali negli uomini e 237 e 159 casi rispettivamente nelle donne. L'associazione tra la BMI e il rischio di cancro al colon differiva tra i siti secondari negli uomini (p = 0.02), ma non nelle donne (P = 0.95). Negli uomini, gli HR (IC 95%) per 5 kg / m2 erano 1,07 (0,86-1,33) e 1,49 (1,19-1,87) rispettivamente per il prossimale e distale del colon. Nelle donne, gli HR (IC al 95%) corrispondenti erano 1,15 (0,99-1,34) e 1,25 (1,05-1,49). Tra gli uomini in sovrappeso (BMI ≥25 kg / m2), l’aumento di peso ≥10 kg dava un rischio di cancro al colon più elevato del mantenimento del peso (HR, 2,09, IC 95%, 1,21-3,63), mentre i rischi erano simili tra gli uomini con peso stabile, con sua perdita, o con guadagni minori di 10 kg. Nelle donne, invece, il cambiamento di peso non si associava con il rischio.
In conclusione, l'influenza della BMI sul rischio di cancro al colon differiva negli uomini tra i siti secondari. Gli aumenti di peso inferiori ai 10 kg non influenzavano il rischio.
I risultati, quindi, supportavano le differenze di genere e l'ipotesi di differenti eziologie per le varie sedi del colon.
Pereira F dell’Instituto de Investigaciones Biomédicas Alberto Sols dell'Universidad Autónoma de Madrid, Spain e collaboratori hanno voluto dimostrare che l'espressione delloJMJD3 (histone H3K27me3 demethylase Jumonji domain containing 3) umana era indotta dal metabolita attivo della vitamina 1α, 25-dihydroxyvitamin D(3) (1,25(OH)(2)D(3)) (Hum Mol Genet. 2011 Dec 1;20(23):4655-65).
In effetti, lo JMJD3 modula il gene dell'atto normativo di quest’ormone e la 1,25 ( OH ) ( 2 ) D ( 3 ) attiva il promotore del gene JMJD3, aumentando il livello dello JMJD3 RNA nelle cellule tumorali umane.
Da notare che il KDM6B/JMJD3 è una demetilasi istonica H3 della lisina con un importante ruolo regolatorio genico sullo sviluppo e sulla fisiologia.
La sovra regolazione dell’JMJD3 era strettamente dipendente dall’espressione del VDR (vitamin D receptor) ed era abolita dalla cicloeximide. Nelle cellule tumorali del colon SW480 - ADH, l’abbattimento dello JMJD3, o l'espressione di un frammento mutante inattivo, diminuiva l'induzione da parte della 1,25 ( OH) ( 2) D ( 3) di diversi geni bersaglio e di un fenotipo adesivo epiteliale. Inoltre, l’abbattimento dello JMJD3 sovra regolava gli induttori di transizione epitelio-mesenchimali SNAIL1 e ZEB1 e i marcatori mesenchimali fibronectina e LEF1, mentre sotto regolava le proteine epiteliali E - caderina, Claudina - 1 e Claudina - 7. Inoltre, l’abbattimento dello JMJD3 aboliva l'esportazione nucleare della β-catenina e l'inibizione dell’attività trascrizionale della β-catenina provocata dalla 1,25 ( OH) ( 2) D ( 3).
Infine, gli Autori ritenevano importante sottolineare che in una serie di novantasei tumori del colon umani l'espressione dello JMJD3 correlava direttamente con quella del VDR e inversamente con quella dello SNAI1.
Per la prima volta i risultati indicavano, quindi, che un gene epigenetico codificante una demetilasi istonica, come lo JMJD3, era un co-bersaglio VDR che mediava parzialmente gli effetti della 1,25 (OH) ( 2) D (3) sul colon umano.
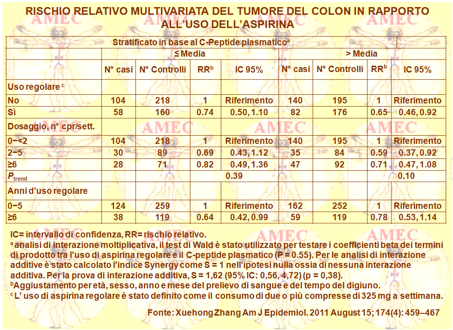
Xuehong Zhang del Channing Laboratory at Landmark Center, Boston e collaboratori hanno valutato, per loro canto, in 1.701 casi di cancro del colon, diagnosticati durante il follow-up fino a ventisei anni nei 139.310 partecipanti in due studi di coorte prospettici degli Stati Uniti con inizio nel 1980 e nel 1992 rispettivamente, l’associazione tra la neoplasia e l’aspirina in base all'indice di massa corporea e all'attività fisica (Am J Epidemiol. 2011 August 15; 174(4): 459–467).
Erano esaminati i livelli plasmatici del peptide C modificato e l'associazione mediante uno studio caso-controllo (n = 384 casi, 749 controlli). Erano, peraltro, testate le interazioni moltiplicative e additive. L’indice di massa corporea non modificava l'associazione e il pool delle multivariabili del rischio relativo per l'uso regolare dell’aspirina contro il non-uso. Si registrava, quindi, una variazione di 74-0,75 nei normopeso e negli obesi con P = 0,75 nel test per l'interazione moltiplicativa e P = 0,66 in quello per l'interazione additiva. Il pool dei rischi relativi multivariati per l'uso regolare dell’aspirina era 0,86 [IC 95% (intervallo di confidenza): 0.66, 1.11] nella bassa attività fisica e 0,67 (IC 95%: 0,58, 0,77) per l’alta senza alcuna interazione evidente né sulla scala moltiplicativa né additiva (P> 0,10). I livelli plasmatici del peptide C, inoltre, non modificavano l’associazione tra aspirina e cancro del colon, secondo rischi multivariabili relativi di 0,74 (IC:95% = 0.50, 1.10) per la bassa e 0,65 (IC:95% = 0,46, 0,92) per l’alta. La riduzione del rischio di cancro del colon, associato all'uso dell’aspirina non era, comunque, significativamente modificata in base all'indice di massa corporea, all’attività fisica o al livello plasmatico del C-peptide.
Aya Kuchiba dell’Harvard Medical School, Boston e collaboratori hanno voluto valutare, invece, le possibili variazioni tra la BMI (body mass index) e il rischio di cancro del colon-retto secondo l'espressione della FASN (Fatty acid synthase), la quale, come accennato in precedenza, è iperespressa in alcuni tumori del genere e gioca un ruolo importante nel metabolismo energetico degli acidi grassi, catalizzandone la sintesi (JNCI J Natl Cancer Inst (2012) doi: 10.1093/jnci/djr542).
Durante il follow-up di 109.051 donne del Nurses Health Study tra il 1986 e il 2004 si diagnosticavano 1.351 cancri del colon e del retto. In 536 campioni tumorali asportati, gli Autori analizzavano l'espressione FASN mediante immunoistochimica. Il HR (Hazard ratio) e gli IC al 95% (intervalli di confidenza) erano calcolati usando modelli di regressione di Cox del rischio proporzionale.
L’alto indice di massa corporea si associava a un aumentato rischio di cancro colon-retto FASN-negativi (espressione assente o debole), rispetto alla normale con BMI alto. Valeva a dire che negli obesi con BMI≥ 30 kg/m2 vs i normopeso con BMI di 18,5-22,9 kg/m2 l’HR era uguale a 2.25, IC 95% = 1,49-3,40, P <.001. Ciò non era presente nei soggetti FASN-positivi con espressione da moderata a forte. Si osservava, inoltre, un’eterogeneità statisticamente significativa dei rischi di cancro del colon-retto tra i casi FASN-negativi e i FASN-positivi (Pheterogeneity = 0,033). I tassi d’incidenza per 100 000 persone-anno per i tumori FASN-positivi e negativi del colon-retto, aggiustati per età, erano 10.9 e 7.1 rispettivamente.
In conclusione, questo studio epidemiologico molecolare patologico sosterrebbe, invero, un ruolo del metabolismo energetico nella patogenesi del cancro del colon-retto.
E. Yehuda-Shnaidman e B. Schwartz dell’Hebrew University of Jerusalem, stimolati dalla crescente epidemia globale dell’obesità e dal consequenziale aumento del rischio di tumore del colon-retto, il terzo più comune e la seconda causa di morte tra gli adulti dei paesi occidentali, hanno esaminato le interazioni tra gli adipociti e le cellule immunitarie che possono alterare il metabolismo verso la promozione del cancro stesso (Obesity Reviews Vol 13, Issue 12, pages 1083–1095, December 2012).
Hanno, così, precisato che il tessuto adiposo dell’obeso si differenzia da quello del magro per la distribuzione e il profilo immunogenico e metabolico. In effetti, il tessuto adiposo dell’obeso rilascia acidi grassi liberi, adipochine e molte chemochine pro-infiammatorie, fattori noti per svolgere un ruolo chiave nella regolazione della trasformazione maligna e della progressione del cancro. Il tessuto adiposo dell’obeso è, inoltre, infiltrato da macrofagi che partecipano alle vie infiammatorie attivate nel tessuto. Questi sono di due diversi fenotipi: M1 che risiedono nel tessuto adiposo dell’obeso e producono citochine pro-infiammatorie, M2 presenti nel tessuto adiposo dei magri e che producono citochine anti-infiammatorie, come l’IL-10 (interleuchina-10). Pur tuttavia, le reti metaboliche che conferiscono alle cellule tumorali le proprietà oncogeniche, quali la proliferazione aumentata e la capacità di evitare l'apoptosi, non sono ancora ben chiare.
Nisa M. Maruthur della Johns Hopkins University School of Medicine e collaboratori, proprio considerando che l'obesità si associa a un aumento della mortalità per cancro del colon e anche ai più bassi tassi di mammografia e Pap test, hanno condotto una revisione sistematica per valutare tale dato (Cancer Epidemiol Biomarkers Prev May 2012 21; 737).
Gli Autori hanno, così, cercato nella letteratura recensioni, citazioni, abstract e articoli in modo indipendente con lo screening per le seguenti categorie dell’indice di massa corporea (BMI): normale come riferimento da 18,5-24,9 kg/m2; sovrappeso da 25-29,9 kg/m2, obesità di classe I da 30-34,9 kg/m2, obesità di classe II da 35-39,9 kg/m2 e obesità di classe III ≥ 40 kg/m2.
Gli Autori, così, includevano ventitré articoli delle 5.543 citazioni. Quasi tutti gli studi erano trasversali e la BMI e gli screening erano accertati attraverso l'auto-report.
La BMI non si associava in generale con lo screening del cancro del colon. Il sottogruppo di donne obese bianche riportava tassi più bassi di screening del cancro del colon, rispetto a quelle con un BMI normale con OR combinato (IC 95%) di 0,87 (0,82-0,93), 0,80 (0,65-0,99) e 0,73 (,58-,94) per la classe di obesità I, II, III rispettivamente. I risultati erano simili per gli uomini bianchi con obesità di classe II.
In conclusione, gli studiosi affermavano che nel complesso la BMI non si associava con lo screening del cancro del colon. Gli uomini e donne bianche obesi mostravano minore probabilità di sottoporsi allo screening per il cancro del colon, rispetto a quelli con un normale indice di massa corporea. Sulla base di questo studio gli Autori suggerivano, quindi, ulteriori indagini su questa disparità per tendere a ridurre il rischio di morte per cancro del colon negli obesi.
Susan Hongha Vu della Washington University School of Medicine a St. Louis e collaboratori, proprio considerando l’evidenza dell'associazione tra diabete di tipo 2 e aumento del rischio di cancro al colon, ma anche di lesioni precancerose, non essendoci a loro conoscenza il suggerimento di sottoporre i malati metabolici di questo tipo a screening cautelativo d’indagini mirate, hanno esaminato le cartelle cliniche di tre gruppi di persone che avevano eseguito una colonscopia per un periodo di sei anni presso il loro istituto:
1) 125 diabetici di tipo 2 di età dai quaranta ai quarantanove anni,
2) 125 non diabetici dai quaranta ai quarantanove anni,
3) 125 non diabetici dai cinquanta ai cinquantanove anni.
La colonscopia aveva trovato almeno un polipo precanceroso nel: 1) 30%, 2) 14%, 3) 32%.
Pur tuttavia, gli Autori precisavano che il loro studio non provava che il diabete fosse la causa o contribuisse direttamente alla crescita del polipo. Difatti, i diabetici potevano avere altri fattori di rischio non misurati per l’incidenza degli adenomi e del cancro del colon. Comunque, il dato andava considerato anche alla luce del fatto che i diabetici hanno nel sangue livelli anormalmente elevati d’insulina, ormone che può alimentare la crescita delle cellule, comprese quelle precancerose.
Si proponeva, però, una domanda immediata:
in caso di diabete era opportuno sottoporsi a screening per il cancro del colon in età più giovane di quanto di solito consigliato dalle linee guida correnti? (Digestive Disease Week, San Diego, May 19-22, 2012)
Gloria Y.F. Ho dell’Albert Einstein College of Medicine London, United Kingdom e collaboratori, volendo chiarire le associazioni meccanicistiche tra obesità e cancro del colon-retto, hanno voluto studiare il possibile ruolo delle adipochine come fattori di rischio e se esse potessero mediare l’associazione con l'obesità (Cancer Res. Jun 15, 2012; 72(12): 3029–3037).
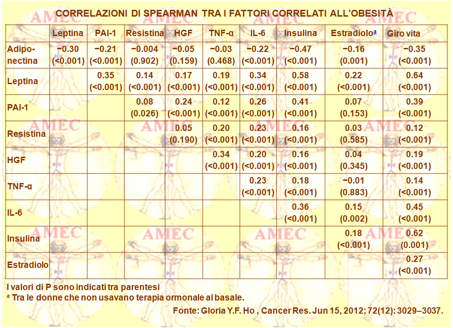
Gli Autori, all'interno dello studio Women's Health Initiative delle donne in postmenopausa, hanno ricavato campioni di plasma basale di 457 casi di cancro del colon-retto e in 841 soggetti di sottocoorte hanno analizzato l’adiponectina, la leptina, il PAI-1 (plasminogen activator inhibitor-1), la resistina, il fattore di crescita degli epatociti, IL-6 (interleukin-6) e il TNF-α. Erano anche disponibili per l'analisi dei dati i valori d’insulina e di estradiolo, misurati in precedenza. Dopo aggiustamento per età, razza, fumo, storia di colonscopia e livello di estrogeni, correlavano con un aumentato rischio di cancro del colon-retto un basso livello di adiponectina e degli alti livelli di leptina, di PAI-1 e di IL-6, anche se solo la leptina rimaneva significativa dopo ulteriore aggiustamento per l’insulina [HR confrontata tra i quartili estremi (HRQ4-Q1), 1.84; IC 95%= 1,17-2,90]. L’analisi di mediazione dimostrava che la leptina e l’insulina parzialmente spiegavano l'associazione tra la circonferenza della vita e il cancro del colon-retto e l’attenuavano del 25 e 37% rispettivamente, con l'insulina come mediatore significativo (P = 0,041).
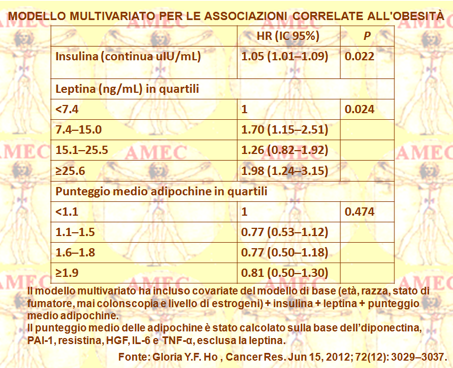
I risultati supportavano, quindi, l’affermazione che le adipochine, coinvolte nel processo infiammatorio, erano associate al rischio di cancro del colon-retto ma che i loro effetti potevano essere mediati soprattutto dall’insulina, con la leptina che esercitava un effetto indipendente. L'iperinsulinemia e l’iperleptinemia potevano, quindi, parzialmente spiegare l'associazione tra l’adiposità e il cancro colorettale nelle donne in postmenopausa.
Teppei Morikawa dell’Harvard School of Public Health, Boston, Massachusetts e collaboratori hanno condotto un'analisi sui pericoli di regressione proporzionale di Cox con il metodo della duplicazione dei dati per valutare le associazioni differenziali tra la BMI (body mass index) o l’attività di esercizio fisico con il rischio di cancro colorettale secondo lo stato CTNNB1 del tumore (Cancer Res; 73(5); 1–11. ©2013 AACR).
Tutto ciò sulla base che la disregolazione della via di segnalazione del WNT / β -catenina (CTNNB1) è implicata nel carcinoma del colon-retto e nelle malattie metaboliche. Gli Autori hanno, infatti, ipotizzato che lo stato del tumore CTNNB1 potesse influenzare la sensibilità cellulare all’obesità e all'attività fisica. Nel follow-up clinico di 109.046 donne del Nurses' Health Study e di 47.684 uomini del Health Professionals Follow- up Study, ricorrevano 861 incidenti cancri del retto e del colon con i dati d’immunoistochimica sull’espressione tessutale del CTNNB1 nucleare. Usando questo database epidemiologico di patologia molecolare, gli Autori hanno rilevato che la più alta BMI si associava con un rischio significativamente maggiore di cancro CTNNB1 negativo [HR multivariata = 1.34; intervallo di confidenza (IC) 95 % 1,18-1,53 per incremento di 5,0 kg/m2; P trend = 0.0001]. Lo stesso non si aveva con il rischio di cancro CTNNB1 - positivo (HR multivariato = 1,07, IC 95%, 0,92-1,25 per incremento di 5,0 kg/m2; P trend = 0.36; P per eterogeneità = 0,027 tra rischio di cancro CTNNB1 - negativo e CTNNB1 positivo). Il livello di attività fisica si associava con un minor rischio di cancro CTNNB1 -negativo (HR multivariato = 0.93, IC 95%: 0,87-1,00 per incremento di dieci MET-h/sett.; P trend = 0.044 ). Lo stesso non si rilevava con il rischio di cancro CTNNB1 positivo (HR multivariata = 0.98, IC 95%: 0,91-1,05 per incremento di dieci MET-h/sett.; P trend = 0.60).
In conclusione, secondo gli Autori i risultati confermavano che l'obesità e l'inattività fisica erano associate con un rischio più elevato di cancro colorettale ma soltanto per il CTNNB1–negativo, rappresentato dal 54% dei casi esaminati, e non per quello CTNNB1 positivo, riprodotto dal restante 46%. Inoltre, indicavano che il bilancio energetico e lo stato metabolico esercitavano il loro effetto in uno specifico percorso di carcinogenesi meno probabilmente dipendente dall'attivazione WNT/CTNNB1. Questo studio evidenziava, invero, l'importanza dell’eterogeneità del tumore generalmente considerato come una singola malattia. In effetti, se i medici fossero in grado di identificare le persone inclini a sviluppare il cancro CTNNB1-negativo allora sarebbe possibile raccomandare più fortemente l'attività fisica.
Ma Y della Tongji University, Shanghai, People’s Republic of China e collaboratori hanno condotto una revisione sistematica degli studi prospettici sull'associazione dell’obesità con il rischio di cancro colorettale (PLoS ONE, 2013 - 8(1): e53916. doi:10.1371).
Tra il 1992 e il 2012 erano stati pubblicati quarantuno studi con misurazione del BMI (body mass index), coinvolgendo un totale di 85.935 casi su 8.115.689 partecipanti. Di questi studi, diciassette erano stati condotti negli Stati Uniti, dodici in Europa, sette in Asia, quattro in Australia e uno in Canada. I tredici studi con misurazione della WC (waist circumference) erano stati pubblicati tra il 1995 e il 2012 con un totale di 6.546 casi su 817.449 partecipanti. Di questi, sette erano stati condotti negli Stati Uniti, tre in Europa e tre in Australia. La maggior parte degli studi aveva fornito stime di rischio che in trentasei erano aggiustate per l’età, in trentadue per il fumo, in ventitré per l’attività fisica, in ventitré per il consumo di alcol. Un minor numero di studi era stato aggiustato: nove per l'assunzione di calorie, otto per l’uso di FANS / Aspirina, sette per l’assunzione di folati, sei per quella del calcio, sei per il diabete. Pochissimi erano stati adeguati per lo screening del cancro del colon retto.
In sintesi, i risultati di questa meta-analisi di studi prospettici dimostravano che i livelli di BMI e WC erano entrambi associati positivamente con il rischio di cancro del colon retto in uomini e donne di differenti aree geografiche e in diverse sedi anatomiche. Tuttavia, secondo gli Autori i dati disponibili erano ancora scarsi ed erano auspicabili ulteriori studi longitudinali per stime più precise e una migliore comprensione del ruolo dell'obesità nei meriti della carcinogenesi della malattia.
Marc Bardou dell’INSERM Dijon, France e collaboratori hanno, per loro conto, esaminato come l'obesità potesse promuovere il cancro del colon retto e il suo comportamento, tentando di quantificare l'impatto dei trattamenti medici e chirurgici ed evidenziando i cambiamenti metabolici a essi associati (Gut 2013;62:933-947).
Gli Autori identificavano, così, tutte le metanalisi, revisioni sistematiche, studi caso-controllo, di coorte o osservazionali che avevano valutato la prevalenza del cancro del colon, o del retto o del colon retto in obesi rispetto ai soggetti non obesi.

Dalle 3.732 citazioni iniziali selezionavano venti metanalisi, cinque recensioni, 113 studi osservazionali e cinquanta ulteriori articoli di supporto. In Europa circa l'11 % dei casi del cancro colorettale (CRC) erano stati attribuiti al sovrappeso e all’obesità. I dati epidemiologici indicavano che l'obesità era associata a un aumentato rischio di cancro al colon nel 30-70% negli uomini, mentre l'associazione era meno consistente nelle donne. Esistevano tendenze simili per adenoma del colon-retto, anche se il rischio appariva più basso. Il grasso viscerale, o l'obesità addominale, sembrava essere più preoccupante di quella dovuta al grasso sottocutaneo e ogni aumento del BMI di 1 kg/m2 conferiva ulteriore rischio (HR 1,03). L'obesità poteva essere associata agli esiti peggiori del cancro, come ricorrenza del tumore primario o di mortalità. Diversi fattori, tra cui una ridotta sensibilità ai regimi terapeutici antiangiogenici, avrebbero potuto spiegare queste differenze. Fatta eccezione per infezione della ferita, l'obesità aveva un impatto significativo sulle procedure chirurgiche. I meccanismi sottostanti che collegavano l'obesità al CRC erano ancora oggetto di dibattito, ma la sindrome metabolica, l’insulino-resistenza e le modifiche nei livelli delle adipocitochine sembravano assumere una grande importanza. Altri fattori biologici come il microbiota intestinale o gli acidi biliari stavano emergendo. Pur tuttavia, molti interrogativi restavano ancora senza risposta.
Ningqi Hou dell’University of Chicago, USA e collaboratori hanno compiuto una revisione sistematica della letteratura dal 1980 al 2013 sui fattori dietetici e di stile di vita di rischio per la prevenzione e la chemioprevenzione del CRC (colorectal cancer) in una popolazione ad alto rischio (Chin Clin Oncol 2013;2(2):13).
Gli Autori hanno, così, rilevato prove convincenti che l'assunzione di aglio, caratterizzato da un elevato contenuto di composti organosolforici e di flavonoidi, di vitamina B6 e di magnesio, la vita attiva, il mantenimento di un peso sano e di vita salutare, evitando o riducendo la carne rossa, l’alcool e il fumo, così come la terapia ormonale sostitutiva nelle donne poteva risultare in una significativa protezione contro lo sviluppo del cancro del colon-retto.
Meno consistenti erano le evidenze per la frutta e le verdure come per le fibre e l’acido folico, il pesce e gli acidi grassi omega-3, il selenio, i latticini, il calcio e la vitamina D. Per le popolazioni ad alto rischio, l'aspirina dimostrava una protezione contro lo sviluppo degli adenomi del colon e del CRC, mentre una dose minima efficace rimaneva poco chiara.
In conclusione, il cancro del colon-retto poteva essere prevenuto nella popolazione generale attraverso interventi sulla dieta e sullo stile di vita. L'aspirina risultava una buona scelta come agente di chemioprevenzione tra gli individui ad alto rischio.
Gregory P Tarr dell’University of Otago, New Zealand e collaboratori hanno voluto determinare la portata dei cambiamenti dello stile di vita autoriferiti in persone a maggior rischio di CRC e l'associazione di questi report con l’ansia, il rischio e le variabili basate sulla conoscenza (BMC Gastroenterology 2014, 14:22).
Gli Autori hanno, così, selezionato in modo casuale 250 partecipanti con colonscopia di prevenzione, sulla base di una storia familiare di CRC. In conformità a un’intervista telefonica, è stata valutata una scala a quattro punti registrando la conoscenza dei fattori di rischio, del rischio personale e della preoccupazione a causa della storia familiare. L’ansia generale è stata valutata utilizzando la scala GAD-7. I risultati aggiustati sono stati ottenuti utilizzando la regressione logistica ordinale.
Si registravano così 148 partecipanti con il 79,7% che riportava almeno un cambiamento sano. I più frequentemente segnalati erano il cambiamento della dieta e dell'attività fisica con il 63% per le fibre, il 54% per la frutta e le verdure, il 47% per la carne rossa, il 45% per l'attività fisica. I cambiamenti nel consumo di tabacco con il 25%, dell’alcol con 26% e del peso corporeo con 31% erano meno probabili. Le persone erano più propense a segnalare il cambiamento sano con più bassi livelli di ansia generalizzata, con maggiore preoccupazione a causa della storia di famiglia, o con una maggiore conoscenza dei fattori di rischio percepiti del CRC. La percezione del rischio e quello dovuto alla storia di famiglia non erano associati ai cambiamenti sani.
Sovrappeso dell'adolescente e rischio di futuro tumore colorettale
Zohar Levi del Rabin Medical Center, Petach Tikva-Israel e collaboratori hanno studiato l'associazione tra il sovrappeso adolescenziale con l'incidenza del cancro del colon-retto in un'ampia coorte di maschi (Cancer Epidemiology Biomarkers & Prevention, 2011; 20 (12): 2524).
Gli Autori hanno misurato la BMI (body mass index) in 1.1 milioni di maschi ebrei israeliani sottoposti a un esame globale della salute in età tra i sedici e i diciannove anni nel periodo 1967 - 2005. Il sovrappeso è stato definito da un indice di massa corporea ≥ 85 percentile della distribuzione standard degli Stati Uniti durante l'adolescenza. Il cancro colorettale è stato identificato mediante collegamento con l’Israel National Cancer Registry fino al 2006. Il follow-up medio era di 17,6 ± 10,9 anni, riflettendo 19.500.000 anni-persona. Gli Autori hanno utilizzato il modello di Cox dei rischi proporzionali. La prevalenza del sovrappeso adolescenziale era aumentata dal 9,9% al 16,8% dalle prime dieci coorti di esame annuale, rispetto alle ultime dieci. Si rilevavano 445 cancri del colon e 193 del retto. Il sovrappeso faceva prevedere un aumento del rischio di cancro al colon [HR = 1.53, intervallo di confidenza 95% (IC), 1,17-2,02, p = 0,002], ma non di cancro del retto (HR = 1.09, 95% IC, 0,38-1,73, p = 0,72 ). Il rischio era maggiore per l'adenocarcinoma non mucinoso del colon (HR = 1.68, 95% IC, 1,26-2,23, p = 0,001). Peraltro, l'associazione della BMI ≥ 85 percentile con il cancro del colon era ancora più marcata nelle analisi limitate a seguire gli uomini fino ad almeno i quaranta anni di età [N = 367.478; HR = 1,75 (95% IC, 1,33-2,3, P <0.001) ].
In conclusione il sovrappeso adolescenziale era sostanzialmente associato con l'incidenza del cancro del colon.
Elizabeth Kantor dell’Harvard School of Public Health in Boston, Massachusetts e collaboratori, considerando che sia l'obesità sia l'infiammazione avevano ottenuto un’evidenza di associazione con il rischio del cancro del colon-retto in età adulta, senza chiara conoscenza del ruolo delle esposizioni precoce di vita nello sviluppo della malattia, hanno svolto uno studio nei meriti presentato a New Orleans durante il 13° Annual American Association for Cancer Research (AACR), International Conference on Frontiers in Cancer Prevention Research del 28 settembre - 1 ottobre 2014.
Gli Autori hanno analizzato i dati raccolti su 239.464 uomini svedesi che avevano partecipato dal 1969 al 1976 al servizio militare tra i sedici e venti anni. A quel tempo erano stati misurati la velocità di sedimentazione eritrocitaria, come marker dell’infiammazione, l’altezza e il peso.
Durante un follow-up medio di trentacinque anni, fino al primo gennaio 2010 si registravano 885 casi di tumore del colon-retto. Per precisione 501 uomini avevano sviluppato il cancro al colon e 384 quello rettale.
I ricercatori scoprivano, così, che gli obesi nel periodo adolescenziale presentavano delle probabilità 2,37 volte maggiori di sviluppare il cancro del colon-retto rispetto a chi era di peso normale. Anche l’alto grado d’infiammazione, rilevato dal tasso di sedimentazione degli eritrociti, correlava con un rischio maggiore del 63% di cancro colorettale rispetto al basso.
Obesità addominale e rischio di cancro del fegato e delle vie biliari
L’obesità ha recentemente attirato molta attenzione come fattore di rischio per il cancro al fegato. Ciò prevalentemente in ragione del crescente interesse sulla steatoepatite non alcolica, condizione comune di patologia della ghiandola. Peraltro, recenti studi suggeriscono che l'obesità può avere un ruolo nello sviluppo del cancro al fegato nella cirrosi alcolica o nell’epatite virale, ma anche nella popolazione generale.
Per quanto riguarda il rischio di cancro della colecisti, esso suole aumentare con gli alti valori della BMI. Com’è noto, questo cancro è relativamente infrequente ma altamente letale. L'obesità può entrare in causa:
- alterando il metabolismo dei lipidi e degli ormoni endogeni,
- influenzando la motilità della colecisti,
- aumentando il rischio di calcoli biliari,
- svolgendo, quindi, un ruolo di fattore di rischio per il cancro.
Sun B della Nanjing Medical University, China, partendo proprio dal presupposto che nel 21° secolo anche nei paesi in via di sviluppo l'obesità è diventata un problema di salute pubblica universale e importante in crescente aumento negli adulti ma anche nei bambini, ha ribadito i risultati degli ampi studi epidemiologici sul suo forte legame con lo sviluppo e la progressione di vari tipi di tumori (J Hepatol. 2012; 56(3):704-13).
In particolare, il collegamento tra obesità e cancro del fegato è particolarmente forte e l'obesità spesso si traduce in malattie come la NAFLD (non-alcoholic fatty liver disease) e la più grave NASH (non-alcoholic steatohepatitis). Quest’ultima è caratterizzata da un’infiammazione del fegato grasso imputata di provocare fibrosi e cirrosi. Quest'ultima patologia è un noto fattore di rischio di cancro al fegato. Nei fatti, grazie all’elevata prevalenza dell’obesità, essa può contribuire all’onere complessivo del carcinoma epatocellulare, molto più sostanzialmente dell’infezione dei virus dell'epatite. L’Autore nella sua produzione ha passato in rassegna e ha discusso i recenti progressi scientifici rivolti alla delucidazione delle alterazioni cellulari e molecolari e delle vie di segnalazione associate con l'obesità e l’infiammazione del fegato e il loro contributo alla epatocarcinogenesi.
Tanaka K della Saga University, Japan e collaboratori hanno esaminato sistematicamente gli studi epidemiologici sul sovrappeso / obesità e il cancro del fegato tra le popolazioni giapponesi. La ricerca è stata effettuata in termini di ampiezza di associazione in ogni studio e della forza delle prove, da convincenti, a probabili, possibili, o insufficienti, insieme alla plausibilità biologica (Jpn J Clin Oncol. 2012; 42(3):212-21).
Tra i nove studi di coorte identificati, cinque, di cui quattro su pazienti con malattia epatica cronica e uno sui residenti locali, facevano registrare un’associazione positiva da debole a forte, mentre quattro, di cui uno su un paziente con epatite B e tre su residenti locali, non riscuotevano nessuna associazione [rischio relativo riassuntivo per aumento di un’unità d’indice di massa corporea (kg / m 2) 1.07, intervallo di confidenza 95%: di 1,03-1,10]. Tutti e tre questi studi caso-controllo identificati, due su pazienti cirrotici e uno sui sopravvissuti alla bomba atomica, riportavano una forte associazione positiva (sintesi del rischio relativo 1.31, intervallo di confidenza 95%: 1,12-1,53).
Nel complesso, il rischio relativo di sintesi è stato stimato in 1,13 (intervallo di confidenza 95%: 1,07-1,20) e gli individui in sovrappeso / obesi avevano un rischio relativo di 1.74 (intervallo di confidenza 95%: 1,33-2,28) rispetto a chi aveva un peso normale / basso.
In conclusione, il sovrappeso o l'obesità aumentavano probabilmente, in misura moderata, il rischio di cancro primario del fegato tra la popolazione giapponese.
Schlesinger S dell’University of Kiel, Germany e collaboratori, con il presupposto delle evidenze già acquisite sull’associazione positiva tra l’obesità generale e rischio di cancro del fegato e delle vie biliari, hanno voluto esplorare più precisamente il ruolo dell’adiposità centrale (Int J Cancer. 2013; 132(3):645-57).
Gli Autori hanno, così, utilizzato modelli di Cox multivariati per indagare in 359.525 uomini e donne dell’European Prospective Investigation into Cancer and Nutrition study le associazioni tra peso, indice di massa corporea, circonferenza vita e fianchi, rapporto vita-fianchi e vita-altezza (WHtR), variazioni del peso durante l'età adulta e il rischio di carcinoma epatocellulare (HCC), di cancro del sistema biliare intraepatico (IBDC) e del dotto extraepatico [EBDSC], tra cui il cancro della colecisti (GBC). Misuravano anche in un sottogruppo di studio caso-controllo lo stato dei virus epatite B e C. Nel corso di un follow-up medio di 8,6 anni occorrevano 177 casi di HCC, cinquantotto di IBDC e 210 di EBDSC, tra cui settantasei di GBC. Tutte le misure antropometriche erano positivamente associate al rischio di HCC e GBC. Il WHtR mostrava, in particolare, la più forte associazione con il HCC. Il rischio relativo (RR), che confrontava i terzili estremi, era 3.51, l’intervallo di confidenza al 95% (IC 95%) era 2,09-5,87, il p <0.0001. Con il GBC si otteneva anche un risultato positivo (RR: 1,56, 95% IC: 1,12-2,16 per un incremento di un’unità in WHtR). L'aumento di peso durante l'età adulta era associato positivamente con il HCC quando si confrontavano i terzili estremi (RR: 2,48, IC 95%: 1,49-4,13; <0.001). Nessuna associazione statisticamente significativa si osservava tra l’obesità e il rischio di IBDC e di EBDSC.
I risultati portavano gli Autori a rilevare l’evidenza di un'associazione tra l’obesità, in particolare quella addominale, e il rischio di HCC e GBC tanto da supportare la raccomandazione di sanità pubblica di ridurre il peso in età adulta per la prevenzione dello HCC e dello GBC nelle popolazioni occidentali.
Obesità e cancro del pancreas
Nella terza tappa del tour nazionale voluto dall’AIOM e da “Insieme contro il cancro” e che ha toccato Roma il 22 maggio 2014, si è affermato che il tumore del pancreas, forma aggressiva e molto diffusa, colpisce ogni anno oltre 12.000 persone in Italia, di cui circa 1.150 nel Lazio. Pur tuttavia, non sembra esserci particolare informazione pubblica, poiché il 77% dei cittadini non ne conosce i sintomi, l’88% non ha mai letto nulla nei meriti e il 97% non ne ha mai parlato con il proprio medico di famiglia, pur con l’81% abbastanza interessato a saperne di più. È quanto è emerso dal sondaggio della campagna nazionale di sensibilizzazione “PanCrea: creiamo informazione”.
L’informazione in tal caso è particolarmente importante, soprattutto per la prevenzione poiché si tratta di una malattia molto difficile da curare. Uno stile di vita salutare è, invece, efficace nel ridurre il rischio anche del cancro del pancreas. Purtroppo, sulla base del 49% delle oltre 1.500 persone che hanno risposto al sondaggio, una condotta sana serve a poco. In effetti, il 23% era fumatore, ignorando i danni della sigaretta, il 55% non praticava esercizio fisico con regolarità e soltanto uno su dieci consumava le porzioni raccomandate di frutta e verdura.
In particolare, il cancro del pancreas, corrispondente a circa il 6% di tutte le forme neoplastiche maligne, è caratterizzato da un basso tasso di sopravvivenza a cinque anni e permette in meno del 10% dei pazienti la diagnosi di malattia localizzata e, quindi, di resezione chirurgica curativa. La sua incidenza, peraltro, è crescente e legata ad alcuni fattori di rischio ben noti. Sono disponibili, peraltro, nei suoi meriti, numerose statistiche relative a diversi paesi industrializzati, piuttosto simili tra loro. Nuove ricerche hanno anche dimostrato, potendo identificare i pazienti ad alto rischio con marcatori meglio applicabili, come il cancro al pancreas si sviluppa nel corso degli anni. L'obesità è uno dei pochi fattori di rischio modificabili associati al suo aumento. Peraltro, essa è correlata all’aumentato rischio del diabete, condizione che, a sua volta, è anch’essa associata allo sviluppo della neoplasia.
Inoltre, la predisposizione ereditaria al cancro del pancreas sembra che possa contribuire significativamente alla sua incidenza, rappresentando in tal modo un'opportunità per lo sviluppo di strategie di diagnosi precoce. Pur tuttavia, la base genetica della predisposizione rimane inspiegabile in un’elevata percentuale di pazienti. Una predisposizione ereditaria al cancro del pancreas è, in effetti, prevalente in circa il 3% dei casi di PC e attualmente si ritiene che si verifichi in tre contesti clinici distinti:
- sindromi tumorali ereditarie di predisposizione, con un aumento del rischio di PC, come la sindrome di Peutz-Jeghers e la FAMMM (Familial atypical multiple mole melanoma),
- la pancreatite ereditaria e la fibrosi cistica, in cui le modifiche del pancreas precoci geneticamente determinate possono predisporre allo sviluppo di PC,
- la FPC (familial pancreatic cancer syndrome).
A tal proposito, Humphris JL del Garvan Institute of Medical Research, Darlinghurst, New South Wales, Australia e collaboratori hanno valutato in una coorte di 766 pazienti con diagnosi di PC (pancreatic ductal adenocarcinoma) le caratteristiche clinico-patologiche (Cancer. 2014 Oct 14. doi: 10.1002/cncr.28863).
I pazienti erano classificati con FPC (familial pancreatic ductal adenocarcinoma) se avessero avuto almeno uno o più parenti di primo grado colpiti dalla malattia.
In caso contrario erano classificati SPC (sporadic pancreatic ductal adenocarcinoma).
La prevalenza di FPC in questa coorte era dello 8,9%. Nelle famiglie FPC con presenza di una coppia genitore-figlio con la malattia, il 71% nella generazione successiva era 12,3 anni più giovane al momento della diagnosi. I pazienti con FPC avevano più parenti di primo grado con un EPM (extrapancreatic malignancy) (42.6% vs 21.2, p <0,0001). In particolare, ricorreva il melanoma e il cancro endometriale, ma non una storia personale di EPM. I pazienti con SPC avevano una maggiore probabilità di essere fumatori attivi, avevano una maggiore esposizione cumulativa al tabacco e un minor numero di lesioni come precursori multifocali. Pur tuttavia, questi rilievi non si associavano in termini di sopravvivenza con le differenze. Il diabete mellito di lunga data per più di due anni si associava, invece, con una scarsa sopravvivenza in entrambi i gruppi.
In conclusione, quindi, lo FPC rappresentava il 9% dei PC e il rischio di malignità nel parentado non sembrava essere limitato al solo pancreas. I pazienti con FPC avevano più lesioni come precursori e includevano un minor numero di fumatori attivi. Pur tuttavia, altri fattori clinico-patologici e altri risultati erano simili a quelli dei pazienti con SPC. Inoltre, alcuni parenti FPC potevano presentare un’anticipazione della malattia.
Bracci PM dell’University of California, San Francisco, ha commentato il basso tasso di sopravvivenza a cinque anni del cancro del pancreas negli Stati Uniti, pari a circa il 6% (Mol Carcinog. 2012; 51(1):53-63). Meno del 10% dei pazienti otteneva diagnosi di malattia localizzata e, quindi, era candidato alla resezione chirurgica curativa. Statistiche simili erano, peraltro, state osservate in altre nazioni industrializzate. Con le nuove evidenze che suggeriscono che il cancro al pancreas si sviluppa nel corso di un certo numero di anni, i marcatori che possono meglio identificare i pazienti ad alto rischio e sono applicabili per la diagnosi precoce ravvivano la promessa di miglioramento di queste terribili statistiche. Come già accennato, l'obesità è uno dei pochi fattori di rischio modificabili riconosciuta in associazione con l’aumentato rischio di cancro al pancreas ed è anche correlata a un aumentato rischio di diabete, condizione a sua volta associata con lo sviluppo della neoplasia. Dati i recenti risultati statistici relativi all’aumento crescente dell’obesità in tutto il mondo, è imperativo promuovere strategie di prevenzione e d’intervento per ridurne l'incidenza e migliorare la prognosi di questa malattia altamente mortale.
L’Autore nel suo lavoro offre una panoramica dell’epidemiologia attuale e i meccanismi biologici ipotizzati, coinvolti nell'associazione carcinoma pancreatico-obesità.
Jiao L del National Institutes of Health, Bethesda e collaboratori, per verificare l'associazione positiva tra l’indice di massa corporea (BMI) e il rischio di cancro al pancreas in rapporto all’età, al sesso, all’abitudine al fumo, all'attività fisica e alla storia di diabete, hanno identificato durante una media di 6,9 anni di follow-up 2.454 pazienti con cancro al pancreas (Cancer Causes Control. 2010 Aug;21(8):1305-14. Epub 2010 Apr 10.).
I ricercatori hanno utilizzato modelli proporzionali di Cox di regressione del rischio nell'analisi dei dati. In una meta-analisi sugli effetti casuali per ogni 5 kg / m2 d’incremento della BMI il rischio relativo (RR) conclusivo era 1,06 (IC 95% (intervallo di confidenza) 0,99-1,13) per gli uomini e 1.12 (95% IC 1,05-1,19) per le donne. Dall'analisi aggregata emergeva che, rispetto al peso normale (BMI: 18,5 <25), lo RR aggiustato era 1,13 (IC 95% 1,03-1,23) per il sovrappeso (BMI: 25 <30) e 1,19 (95% IC 1,05-1,35 ) per l’obesità di classe I (BMI: da 30 a <35).
Le prove d’interazioni degli effetti della BMI con gli altri fattori di rischio non erano, invece, statisticamente significative. Ogni 5 kg / m2 d’incremento della BMI si associava, inoltre, tra gli ex fumatori e gli iniziali, ma non tra i fumatori correnti, a un aumentato rischio del cancro del pancreas (P dell’interazione = 0,08).
Gli Autori, in rapporto ai loro risultati d’indagine, concludevano, quindi, che un elevato indice di massa corporea era un fattore di rischio indipendente per il cancro al pancreas.
Sovrappeso dell'adolescente e rischio futuro di tumore del pancreas
Levi Z e collaboratori hanno voluto studiare l'associazione tra sovrappeso adolescenziale con l'incidenza del cancro al pancreas in una coorte di 720.927 uomini ebrei israeliani. Hanno, così, misurato l’indice di massa corporea (BMI nel corso della visita medica generale in età tra i sedici e i diciannove anni sempre nel periodo 1967 – 1995 (Cancer Causes Control. 2012 Feb;23(2):371-8. doi: 10.1007/s10552-011-9886-5).
IL sovrappeso è stato definito come indice di massa corporea ≥ 85 percentile della distribuzione di riferimento US-CDC nell’adolescenza. Il tumore al pancreas è stato identificato mediante collegamento con l’Israel National Cancer Registry fino al 2006. Il follow-up medio era di 23,3 ± 8,0 anni. Durante i 16.800.000 anni-persona, si rilevavano novantotto casi di cancro al pancreas. Con l’utilizzo di modelli di rischio proporzionale di Cox il sovrappeso in età adolescenziale faceva prevedere un aumento del rischio di cancro al pancreas [hazard ratio (HR) = 2.09, intervallo di confidenza 95% (IC): 1,26-3,50, p = 0,005]. Rispetto agli adolescenti con normale BMI Z-score (da -1 a +1), gli adolescenti con Z-score> 1 mostravano un aumento significativo del rischio [HR, 2.28 (IC 95%: 1,43-3,64), p = 0.001]. Il livello d’istruzione inferiore (anni di scuola da dieci o meno vs gli 11-12 anni) si associava anche a un aumentato rischio di cancro al pancreas [HR 1,90 (IC 95%: 1,27-2,86, p = 0,002)], mentre l'altezza, paese di origine e lo stato d’immigrazione erano indifferenti.
In conclusione il sovrappeso nell’adolescente si associava sostanzialmente con l'incidenza del cancro al pancreas nell’adulto di giovane - mezza età. Secondo gli Autori, applicando le puntuali stime degli ultimi dieci anni di prevalenza del 16,8% dell’eccesso di peso negli adolescenti israeliani, lo studio suggerirebbe una frazione della popolazione del 15,5% (IC 95%: 4,2-29,6%) per il tumore del pancreas attribuibile al sovrappeso adolescenziale nel loro Paese.












.png)





