Obesità e cancro al seno
Ogni anno, nel mondo 450.000 donne muoiono a causa del tumore al seno e circa il 15-20% di quelle colpite ha una forma Her2 positiva. Studi epidemiologici hanno identificato numerosi fattori di rischio che nella donna sono in grado di aumentare la probabilità di sviluppare la malattia e molti di essi sono utilizzati dagli studiosi per modellare la base degli strumenti di valutazione del rischio stesso. Il loro comune denominatore è, peraltro, definito dal loro effetto sul livello e sulla durata dell'esposizione agli estrogeni endogeni.
Sotto quest’aspetto, bisogna ricordare che l'obesità è un problema crescente di salute in tutto il mondo e che il peso corporeo in eccesso è ormai collegato a un aumentato rischio di carcinoma mammario in post-menopausa. Peraltro, vi è anche una crescente evidenza che l'obesità si associ alla prognosi infausta nelle donne con diagnosi di cancro al seno in fase iniziale. Diversi studi, infatti, avrebbero dimostrato che le donne, in sovrappeso o obese al momento della diagnosi del cancro al seno, presenterebbero un aumentato rischio di ricorrenza del cancro e di morte rispetto alle donne più magre. Altre evidenze suggerirebbero che le donne, con aumento del peso dopo la diagnosi di cancro al seno, avrebbero anche un aumentato rischio di scarsi risultati.
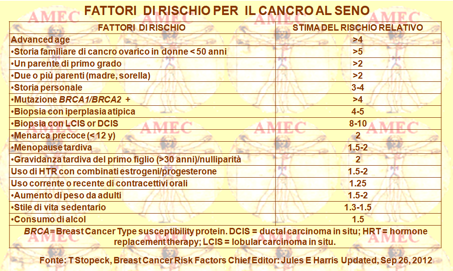
È da notare che il menarca precoce, la nulliparità, la HRT (hormone replacement therapy) e l'obesità in postmenopausa hanno effetti sugli estrogeni. Peraltro, l'aumento del rischio nelle donne obese è probabilmente dovuto alla conversione degli androgeni in estrogeni nel tessuto adiposo.
Pur tuttavia, il dato che l’obesità nelle donne in premenopausa rappresenta un rischio ridotto può concernere le società industrializzate ed essere applicabile solo alle obese più giovani. Peraltro, il rischio più elevato si è rilevato soprattutto nelle donne che non hanno mai utilizzato la terapia ormonale in menopausa e per i tumori che esprimono i recettori sia per gli estrogeni sia per il progesterone. Pur tuttavia, in alcuni studi il sovrappeso e l'obesità sono stati, invece, trovati in correlazione con un ridotto rischio in premenopausa.

Per altro conto, il ruolo del consumo di frutta e verdura, come modificatori alimentari del rischio del cancro al seno, è stato studiato sin dalla metà del secolo scorso. Pur tuttavia, nonostante le varie ipotesi avanzate sui meccanismi protettivi di questi alimenti, i risultati degli studi sono stati contraddittori e solo suggestivi di protezione per la malattia in premenopausa. Allo stato delle conoscenze attuali, si può affermare più semplicemente che una maggiore assunzione selettiva di frutta e verdura può essere efficace per la prevenzione e cura della malattia.
Peraltro, le pazienti affette da tumore della mammella tendono nel primo anno di trattamento a un aumento ponderale pari a circa 5 Kg. Tutto ciò sia per gli steroidi assunti per contrastare gli effetti indesiderati della chemioterapia, sia come evento collaterale della terapia anti-ormonale nel caso di positività ai recettori ormonali. In effetti, sono ormai diversi gli studi che dimostrano come un aumento di peso rappresenta un problema per le pazienti oncologiche, perché, tra l’altro, rende meno efficaci i trattamenti. Per questo nel corso di queste terapie è così importante avere un occhio di riguardo per il metabolismo.
Particolare interesse hanno suscitato i TNBC (triple-negative cancers), che rappresentano circa il 20% delle neoplasie maligne della mammella e che sono caratterizzati dalla mancanza di recettori ormonali, da una particolare aggressività, da una prognosi severa con recidive e corti intervalli di ricorrenza. Per il loro controllo sono usati comunemente diversi agenti antitumorali, come anche l’IR (ionizing radiation), ma con risultati inconsistenti e incompleti. Peraltro, le pazienti possono rispondere bene alle terapie standard, oppure essere completamente resistenti o avere precoci recidive. Pertanto, l’identificazione dei TNBC è utile per il programma di nuovi target terapeutici che possano assicurare una risposta migliore alle cure. In tale contesto, diversi studi avrebbero dimostrato che, combinando due differenti inibitori contro lo stesso target molecolare, si potrebbe ottenere una maggiore efficacia terapeutica. Pur tuttavia, le ricerche in tal senso sono limitate dalla tossicità degli agenti utilizzati. Pertanto, come approccio alternativo, sono allo studio strategie che possano ridurre il processo globale dell’attività del tumore. La CR (caloric restriction), con il ridurre l’assunzione alimentare di circa il 20-30%, è una forma ricercata in tale merito. Essa ha dimostrato, in effetti, di indurre mutamenti nelle diverse parti dei processi di manifestazione del cancro, secondo una modalità interessante da esplorare, senza per questo aggiungere tossicità. Vi sono state evidenze, a tal proposito, che la CR, in combinazione con l’IR, abbia promosso una regressione additiva del tumore.
Weiderpass E del Karolinska Institutet, Stockholm, Sweden e collaboratori, ritenendo scarse le informazioni sull’associazione tra cancro al seno in premenopausa e le dimensioni del corpo durante l'infanzia e l'adolescenza, dal 1991 al 1992 hanno svolto uno studio prospettico di coorte in Norvegia e Svezia (Cancer Epidemiol Biomarkers Prev. 2004 Jul;13(7):1121-7). Sono state incluse nell'analisi 99.717 donne in premenopausa con un follow-up conclusosi nel dicembre 1999. Tra le partecipanti 733 sviluppavano un tumore primario invasivo al seno. Il sovrappeso e l’obesità [indice di massa corporea (BMI)> 25 kg / m2] al momento dell'arruolamento si associavano a un ridotto rischio di cancro premenopausale al seno (P = 0.007). Le apparenti associazioni tra la forma del corpo percepita a sette anni e l’indice di massa corporea all'età di diciotto, con corporatura più pesante a entrambe le età, apparentemente protettive per il rischio di cancro al seno in premenopausa, perdevano la loro significatività statistica dopo aggiustamento per la BMI al momento dell'arruolamento di coorte. La dimensione corporea all'età di sette anni correlava con la BMI all'età di diciotto (r = 0.43), mentre la BMI a diciotto era in relazione con la BMI da adulto (r = 0,48). Le variazioni delle dimensioni del corpo, a sette anni o a diciotto sino all'età adulta, non influenzavano il rischio di per sé di cancro al seno in premenopausa. L’altezza era legata al rischio, con una riduzione differenziale statisticamente significativa del 30% del rischio solo nelle donne più basse di 160 cm, rispetto a quelle più alte. La diminuzione del rischio di cancro al seno in premenopausa si osservava nelle donne in sovrappeso e obese, senza storia familiare per la malattia, ma non in quelle con positività.
Pur tuttavia, l'aumento del peso in età adulta era stato più volte anche indicato come un fattore determinante del rischio di cancro al seno.
Wayne SJ dell’University of New Mexico, USA e collaboratori, per quantificare il cambiamento di assunzione di chilocalorie, macronutrienti e porzioni di frutta e verdura dopo la diagnosi di cancro al seno e per correlare questi stessi cambiamenti con le caratteristiche del soggetto e la modificazione globale dei modelli alimentari auto-riferiti, hanno arruolato duecentosessanta donne del New Mexico con cancro al seno, recentemente diagnosticato tra il luglio 1997 e il marzo 1999 (J Am Diet Assoc. 2004 Oct;104(10):1561-8). Gli Autori hanno rilevato modesti risultati di cambiamento nella dieta nella diagnosi del cancro al seno. Le piccole variazioni nel consumo di frutta e verdura suggerivano agli Autori che si sarebbero dovuti dedicare sforzi maggiori per incoraggiare in queste malate un maggiore consumo di questi alimenti.
Margot P. Cleary e Michael E. Grossmann dell’University of Minnesota, considerando la sostanziale evidenza che l’aumento di peso rappresenta un fattore di rischio importante per lo sviluppo del cancro al seno, soprattutto ormone-sensibile in post-menopausa, capace di determinare anche un impatto negativo sulla prognosi della malattia sia in premenopausa sia in postmenopausa, hanno descritto i possibili meccanismi di tumorigenesi mammaria (Endocrinology. 2009 June; 150(6): 2537–2542.). In effetti, gli elevati livelli degli estrogeni nel sangue, come quelli prodotti localmente, sono stati considerati i mediatori primari degli effetti dell’aumento del peso corporeo sullo sviluppo del cancro al seno nelle donne in postmenopausa. Inoltre, le adipochine, sintetizzate direttamente nel tessuto adiposo, sono state indicate come capaci di influenzare questo sviluppo di malattia influendo sia sui livelli circolanti e sia sulla produzione locale di queste sostanze. Gli Autori nella loro panoramica descrittiva hanno discusso, quindi, il rapporto degli estrogeni sia con l'obesità, sia con il cancro al seno, come entità separate, citando studi importanti e altri fattori di crescita che potevano essere coinvolti in questa relazione.
Healy LA dello St James's Hospital and Trinity College Dublin, Ireland e collaboratori, proprio in virtù dell’associazione tra l'obesità e l’aumentato rischio di cancro al seno in post-menopausa, ma anche dei tassi di mortalità senza ben chiari meccanismi determinanti hanno arruolato 105 donne in postmenopausa con carcinoma mammario di nuova diagnosi (Clin Oncol (R Coll Radiol). 2010; 22(4):281-8). Hanno, così, redatto una dettagliata storia clinica e un’analisi della composizione corporea, dei dati metabolici e della misura delle adipochine e dei marcatori infiammatori. L'età media delle partecipanti era di sessantotto anni, con valori dai quaranta ai novantaquattro anni, e la media dell'indice di massa corporea era 28,3 + / -5,2 kg/m2, con l'87% di obese di tipo centrale. La sindrome metabolica era diagnosticata nel 39% dei casi ed era significativamente associata con l’obesità centrale (P <0,005) e una maggiore infiammazione [livelli di PCR doppi nelle pazienti con sindrome metabolica rispetto a quelle non affette (10.3 vs 5.8 mg / l, P = 0,084)]. Peraltro, le pazienti con una fase patologica successiva (II-IV) presentavano probabilità significativamente maggiori di essere affette da un’obesità generale (P = 0,007), di tipo centrale (P = 0.009), con iperglicemia (P = 0,047) e con iperinsulinemia (P = 0.026). Il 51% aveva la sindrome metabolica, rispetto al 12% con malattia in stadio precoce. I casi con linfonodi positivi alla malattia avevano probabilità significativamente maggiori di essere iperinsulinemici (P = 0,030) e con sindrome metabolica (p = 0.028), rispetto a quelli con linfonodi negativi per la malattia.
I dati, pertanto, suggerivano che la sindrome metabolica e l’obesità centrale erano comuni nelle pazienti con cancro al seno in postmenopausa. Inoltre, la sindrome metabolica poteva essere associata a una biologia tumorale più aggressiva.
Di certo interesse è la revisione riportata da Rowan T Chlebowski del Los Angeles Biomedical Research Institute sulla base d’indagini precliniche e di selezionati studi osservazionali a supporto di un'associazione tra maggiore assunzione di vitamina D e 25-idrossivitamina D con la riduzione del rischio di cancro al seno (Breast Cancer Research 2011, 13:217). Pur tuttavia, l’Autore ha dovuto concludere che le evidenze erano incoerenti e insufficienti per una raccomandazione tassativa nutrizionale. Le evidenze correnti supportavano, difatti, che la necessità di supplementazione di 25-idrossivitamina D dovesse attuarsi in casi studiati a proposito e non in forma routinaria.
Ewertz M dell’Odense University Hospital, Denmark e collaboratori hanno voluto eseguire uno studio per caratterizzare l'impatto dell'obesità sul rischio di recidiva del carcinoma mammario e sulla mortalità (J Clin Oncol. 2011; 29(1):25-31). Su 18.967 donne con noto indice di massa corporea, trattate per cancro al seno in fase iniziale in Danimarca tra il 1977 e il 2006 con follow completo, rilevavano che l'obesità era un fattore prognostico indipendente per lo sviluppo di metastasi a distanza e di morte. Inoltre, gli effetti della terapia adiuvante sembravano disperdersi più rapidamente nelle pazienti obese con cancro al seno.
Yong Heng Yaw dell’Universiti Putra Malaysia e collaboratori, considerando che l'aumento del peso, piuttosto che la sua perdita, si verificava spesso dopo la diagnosi di cancro al seno nonostante le modifiche dello stile di vita salutari adottate dalle superstiti, hanno voluto descrivere la prevalenza e l'entità delle variazioni antropometriche prima e dopo la diagnosi della malattia, prendendo in esame anche i comportamenti di stile di vita in 368 malate (BMC Public Health 2011, 11:309).
Dopo la diagnosi di cancro al seno l'aumento del peso era evidente in questo campione di donne. Così che le informazioni sulla grandezza del cambiamento corporeo con i vari gradi di variazione del peso e degli stili di vita delle superstiti dopo la diagnosi della malattia, secondo gli Autori, avrebbero potuto facilitare lo sviluppo e la destinazione delle strategie d’intervento efficaci per raggiungere il peso sano e la salute ottimale per una migliore sopravvivenza.
Haakinson DJ della Mayo Clinic Arizona e collaboratori hanno svolto una revisione retrospettiva delle pazienti trattate in un unico centro sin dal 2000-2008, mettendo a confronto due gruppi: non obese con indice di massa corporea <30 e obese con indice di massa corporea ≥ 30. Su un totale di 1.352 pazienti il 76% era con obesità e il 24% con peso normale (Ann Surg Oncol. 2012 Sep;19(9):3012-8). Nel confronto per età le obese erano meno frequentemente più giovani dei cinquanta anni, rispetto alle non obese, con un rapporto del 10% contro il 90%. Nel confronto, invece, sopra i cinquanta anni vi era un rapporto del 18%, vs l’82%, p = 0.0019. Peraltro, le obese avevano una maggiore probabilità di diagnosi con il rilievo di studio per immagini, rispetto alle non obese (67% vs 56%, p = 0,0006). Inoltre, le obese presentavano tumori di dimensioni maggiori (1,7 centimetri vs 1,4 cm, P <0.001) e un maggior tasso di linfonodi (LN) metastatici (31% vs 25%, P = 0,026). All'analisi multivariata, l'obesità si associava ai tumori non palpabili e più grandi, a una maggiore incidenza di metastasi LN, a una minore incidenza di positività HER2, a una minore incidenza di multifocalità e a una minore suscettibilità di essere oggetto di ricostruzione dopo la mastectomia.
In conclusione, i dati degli Autori dimostravano che le pazienti obese presentavano, rispetto alle normali di peso, la malattia già clinica alla mammografia in età più tarda e con il cancro in fasi più avanzate. Da ciò, secondo gli studiosi sarebbe derivato il suggerimento di promuovere tra la popolazione delle obese in forma molto pressante le strategie di screening.
Eichholzer M dell’University of Zurich Switzerland e collaboratori, considerando che la popolazione svizzera femminile si distingueva per i bassi tassi di obesità / sovrappeso rispetto agli altri paesi occidentali e che gli stessi erano stabili da più di dieci anni, hanno voluto analizzare l’eccesso ponderale in pazienti con cancro al seno di 51-80 anni, con iniziale diagnosi tra il 1990 e il 2009 (Arch Gynecol Obstet. 2012; 285(3):797-803). I dati erano ricavati dal BBCD (Basel Breast Cancer Database) e poi confrontati con quelli di donne della stessa età delle SHS (Swiss Health Surveys), condotte tra il 1992 e il 2007. Delle 958 pazienti del BBCD in post-menopausa il 32% era in sovrappeso e il 20% con obesità. Delle 14.476 donne delle SHS il 38% era in sovrappeso e il 17% con obesità. Nel BBCD nel corso degli ultimi venti anni non vi era alcun cambiamento di prevalenza del sovrappeso / obesità. Le quattro SHS mostravano, invece, una curvatura convessa per l'obesità, cioè un aumento transitorio. Non si osservavano, comunque, in questo periodo differenze significative tra i dati corretti del BBCD e delle SHS per il sovrappeso e l'obesità.
In conclusione, in questo gruppo di studio svizzero, con una prevalenza relativamente bassa di sovrappeso e obesità, non si osservava alcuna associazione tra il grasso corporeo e il cancro al seno in postmenopausa.
Sparano, J. A. dell’Albert Einstein College of Medicine, New York e collaboratori hanno inteso valutare la relazione tra l’indice di massa corporea e i risultati dei sottotipi di cancro al seno (Cancer, 2012, 118: 5937–5946). In una popolazione di studio clinico che escludeva le pazienti con comorbidità significative, l'obesità era associata con i risultati inferiori. Tutto ciò, in particolare, era evidente nelle pazienti con carcinoma mammario operabile, positive per il recettore ormonale, trattate con la chemioterapia standard e ormonale.
Su-Hsin Chang della Washington University School of Medicine e collaboratori hanno voluto valutare negli Stati Uniti l’influenza dell’obesità sulla mortalità e sull'aspettativa di vita delle donne con cancro al seno (Prev Chronic Dis 2013;10:130112). Hanno, così, utilizzato i dati del National Health Interview Survey 1997-2000, comprendendo donne non fumatrici e non gravide con un indice di massa corporea di almeno 18,5 kg/m2 e nessun cancro diverso dal tumore al seno al momento dell'indagine. Il numero di anni di vita persi per il cancro al seno era più marcato per le donne più obese. Quelle sotto i cinquanta anni e quelle di settanta o più anziane mostravano anche un maggior numero di anni persi rispetto a quelle di età compresa tra i cinquanta e i sessantanove anni.
Pertanto, secondo gli Autori le iniziative di salute pubblica dovrebbero porre maggiormente l'accento sulla prevenzione e il controllo dell’obesità per queste popolazioni più colpite.
Katherine Esposito della Second University of Naples, Italy e collaboratori, non considerando ancora poco chiaro il ruolo della SM (metabolic syndrome) e dei suoi singoli componenti nel rischio del PBC (postmenopausal breast cancer), hanno esaminato e riassunto gli studi epidemiologici sull'associazione delle due condizioni (Menopause. 2013;20(12):1301-1309). In conformità a una ricerca elettronica, senza limiti per articoli pubblicati prima del 31 ottobre 2012, hanno riportato le stime di rischio con il 95% di IC per l'associazione tra SM e PBC. S’includevano nella meta-analisi nove articoli con 6.417 casi di cancro, tutti pubblicati in inglese. La MS si associava con un aumento del 52% nel rischio del cancro (P <0,001). Il dato era per lo più confinato agli studi non di coorte (109% di aumento del rischio). Le stime di rischio cambiavano di poco secondo le popolazioni (Stati Uniti o Europa) e della definizione della sindrome (tradizionale vs non tradizionale). Le stime del rischio per PBC erano 1.12 (P = 0.068) per i valori più alti della BMI/ circonferenza vita, 1.19 (P = 0.005) per l’iperglicemia (alto glucosio a digiuno o diabete), 1.13 (P = 0,027) per la più alta pressione sanguigna, 1.08 (P = 0.248) per i trigliceridi alti, e 1.39 (P = 0.008) per le HDL. Tutte queste stime erano inferiori a quelle associate con la SM negli stessi studi.
In conclusione, la MS si associava con un rischio moderatamente aumentato di PBC. Nessun singolo componente, però, spiegava il rischio veicolato dalla sindrome completa.
Hongchao Pan dell’University of Oxford in the United Kingdom e collaboratori hanno presentato i risultati di uno studio all’Annual Meeting ASCO (American Society Of Clinical Oncology) 2014, basato sui dati dei pazienti di settanta studi clinici, utilizzando l'analisi di regressione di Cox per valutare come il BMI (body mass index) di una paziente potesse influire in maniera indipendente sulla peggiore prognosi del cancro mammario in fase iniziale (J Clin Oncol. 2014, suppl; abst 503.) Delle 60.000 pazienti dello studio con tumore ER-positivo l'obesità si associava a un aumento della mortalità per cancro al seno, indipendentemente dallo stato menopausale (2P <0,00001). Tuttavia, dopo aggiustamento per le caratteristiche del tumore, per 20.000 di queste pazienti in premenopausa il tasso di mortalità era superiore di un terzo nelle donne obese, rispetto alle loro controparti di peso normale che avevano un BMI = 20-25 kg/m2 (rischio relativo [RR] = 1,34, IC 95%: 1,22-1,47; 2P <0,00001), con esiti più gravi e trend costantemente in rapporto agli alti livelli del BMI. Gli Autori rilevavano anche uno scarso effetto indipendente dell’obesità nelle 40.000 donne in postmenopausa con malattia ER-positiva (RR = 1.06, IC 95%, 0,99-1,14; 2P = .12). Vi era anche un aumento del 21,5% in dieci anni del rischio di mortalità del cancro al seno per il sottogruppo in premenopausa. Le pazienti ER-positive obese, rispetto al rischio del 16,6% delle loro controparti di peso normale, mostravano una differenza del 5% (IC, 3,0-6,8).
Pan, commentando che l'obesità aumentava notevolmente i livelli di estrogeni nel sangue solo nelle donne in postmenopausa, si dichiarava sorpreso dei risultati negativi dell'obesità nelle donne in premenopausa. Si doveva, infatti, evincere da tutto ciò che non si era ancora in grado di comprendere in pieno i principali meccanismi biologici con cui l'obesità colpisce la prognosi del tumore.
Mia M. Gaudet dell’American Cancer Society in Atlanta e collaboratori, considerando l’alto indice di massa corporea (BMI) fattore di rischio per il cancro al seno dopo la menopausa, non ritenendo abbastanza chiaro nei meriti il ruolo della circonferenza vita, hanno seguito per una media di 11,58 anni 28.965 donne in postmenopausa, senza terapia ormonale sostitutiva, rilevando il loro peso e il giro vita su un questionario del 1997 (Cancer Causes & Control June 2014, Volume 25, Issue 6, pp 737-745).
I ricercatori durante il follow-up identificavano 1.088 casi di carcinoma mammario invasivo. Una circonferenza vita più grande si associava senza aggiustamento per il BMI a un aumentato rischio del carcinoma mammario (hazard ratio per 10 cm di aumento della circonferenza vita, 1.13; intervallo di confidenza al 95%, 1,08-1,19). La correlazione scompariva dopo aggiustamento per l’indice di massa corporea (rapporto di rischio per 10 cm di aumento della circonferenza vita, 1.00, IC 95%, 0,92-1,08). Il BMI era significativamente associato con il rischio, prima e dopo aggiustamento per la circonferenza della vita (hazard ratio per 1 kg / m², 1.04 [IC 95%, 1,03-1,05] e 1.04 [IC 95%, 95, 1,02-1,06], rispettivamente).
In conclusione, i dati secondo gli Autori supportavano il valore di misurazione del BMI per catturare l'aumento del rischio di cancro al seno in postmenopausa associato alle dimensioni corporee più grandi.
Più grande era la circonferenza della vita, maggiore era il rischio di carcinoma mammario in postmenopausa, ma non oltre il suo contributo all'indice di massa corporea (BMI).
Lianjin Jin della Thomas Jefferson University e collaboratori hanno cercato di determinare (Breast Cancer Research and Treatment, 2014; DOI: 10.1007/s10549-014-2978-7) se l'interazione molecolare tra la CR (Caloric Restriction) e l’IR (Ionizing Radiation) potesse essere mediata dal miR (microRNA).
I microRNA, che regolano altri geni nella cellula e specificamente il miR 17 e 20, diminuiscono maggiormente nei topi trattati sia con radiazioni sia con la restrizione calorica. Questa diminuzione, a sua volta, aumenta la produzione delle proteine coinvolte nel mantenimento della matrice extracellulare. La restrizione calorica favorisce i cambiamenti epigenetici nel tessuto mammario che mantengono forte la matrice extracellulare con una sorta di gabbia intorno al tumore, rendendo più difficile per le cellule neoplastiche di sfuggire e diffondersi in altre parti del corpo.
Comprendere il collegamento per il miR 17 offrirebbe anche ai ricercatori un bersaglio molecolare per la diagnosi di quei tumori che hanno maggiori probabilità di metastasi. Peraltro, offrirebbe una maggiore potenzialità per lo sviluppo di un nuovo farmaco antineoplastico. In effetti, teoricamente un farmaco che possa diminuire il miR 17 potrebbe avere lo stesso effetto sulla matrice extracellulare, come la restrizione calorica. Tuttavia, il targeting di un unico percorso molecolare, come quello del miR17, dovrebbe essere improbabilmente efficace come la restrizione calorica. In particolare, nelle cellule tumorali affamate, si ridurrebbe la concentrazione dei microRNA 17 e 20 (miR 17/20), che di norma sono, invece, abbondantemente espressi nei TNBC (triple-negative breast cancer) metastatizzati. Questi tendono, in effetti, a essere da paziente a paziente geneticamente molto diversi e se la restrizione calorica fosse efficace nelle donne, quanto lo è nei modelli animali, allora probabilmente si potrebbe cambiare il pattern di espressione di un ampio set di geni e colpire senza tossicità bersagli multipli in una sola volta.
Gli Autori hanno condotto la loro ricerca su topine affette da tumore mammario e tenute a restrizione calorica del 30% delle calorie consumate abitualmente. Questa dieta forzata induceva una riduzione delle concentrazioni intracellulari di alcuni microRNA che, secondo gli Autori, avrebbe rappresentato il meccanismo patogenetico di questo effetto anti-tumorale. La dieta ipocalorica avrebbe, in effetti, attivato un particolare programma epigenetico, ostacolando la diffusione del tumore.











.png)





