NOTIZIARIO Maggio 2014 N°5
ECCESSO DI PESO E TUMORI MALIGNI PIÙ A RISCHIO LEGATI AL SESSO
A cura di:
Giuseppe Di Lascio §
Con la collaborazione di:
Eccesso di peso e cancro
Un recente annuncio del NIH (National Institutes of Health), quasi certamente a sorpresa per molti, ha indicato l'obesità in sostituzione del tabacco come il fattore di rischio modificabile più importante per il cancro. In effetti, mentre ormai è molto diffusa la conoscenza del rapporto tra sigarette e cancro al polmone e ad altri tumori, per le neoplasie più comuni solo una minoranza delle persone è consapevole dei gravi rischi associati con il sovrappeso e l'obesità. Peraltro, le stime più recenti indicano che le persone gravemente obese tendono a morire 8-10 anni prima di quelle in normopeso, analogamente ai fumatori. In effetti, per ogni 15 kg di eccedenza ponderale il rischio di morte prematura aumenterebbe del 30% circa. Non a caso l'Organizzazione Mondiale della Sanità ha dichiarato che a livello mondiale almeno 2,6 milioni di persone muoiono ogni anno per essere in sovrappeso o con l’obesità.
Oramai è noto che l’obesità determina una prognosi peggiore delle comorbità e ciò, soprattutto, nel caso del cancro. Anche questo dato può essere sorprendente poiché si è portati ad associare più frequentemente la perdita del peso con la gravità e con la prognosi infausta del cancro.
In Italia, come in molti altri paesi ad alto reddito, per l'aumento dell’esagerato apporto calorico medio giornaliero dal 1950, gli attuali livelli della prevalenza del sovrappeso e dell’obesità sono ormai senza precedenti. Allo stesso tempo, si sono istaurati modelli di vita sempre più sedentari con bisogno reale di calorie giornaliere sempre minori.
I motivi per cui il sovrappeso o l’obesità tendono ad associarsi al cancro devono ricercarsi nelle cellule adipose che, quando s’ipertrofizzano e aumentano di numero, non rimangono inerti e non producono un problema soltanto estetico o meccanico. Nel corso del tempo, in cui s’ingrandiscono per immagazzinare più energia, alla fine possono morire. Determinano, così, un’infiammazione localizzata che ha dimostrato di contribuire alla crescita e alla progressione di alcuni tumori.
Pur tuttavia, essendo l'obesità una malattia complessa, è difficile stabilire esattamente con quali precisi meccanismi s’inserisce nella fisiopatologia del cancro, anche perché ogni malato, con le proprie e personali esposizioni biologiche e ambientali, configura un caso autonomo a parte. I vari meccanismi biologici proposti per spiegare l'associazione possono, comunque, riassumersi in:
• La massa grassa produce quantità in eccesso di estrogeni, i cui alti livelli sono stati da qualche tempo ricollegati al maggiore rischio di cancro al seno, all'endometrio e ad altri tumori.
• Le persone obese hanno spesso aumenti dei livelli ematici d’insulina e del fattore della crescita - 1 insulino-simile, sostanze che possono promuovere lo sviluppo di alcuni tumori.
• Le cellule grasse producono ormoni, chiamati adipochine, che possono stimolare la crescita anormale delle cellule. In effetti, il cancro è fondamentalmente una malattia caratterizzata dalla crescita di cellule impazzite. Le cellule di grasso possono incidere, quindi direttamente o anche indirettamente, su altri regolatori della crescita tumorale.
• Le persone obese spesso soffrono di un’infiammazione cronica a basso livello, che si associa con un aumento del rischio di cancro.
• Alterazioni delle risposte immunitarie e dello stress ossidativo possono entrare in gioco come altri possibili fattori.
D’altro canto, se da una parte un numero sempre crescente di studi sta dimostrando che i chili in eccesso aumentano il rischio del cancro, in particolare del colon, del pancreas, del rene, della tiroide, della mammella, dell'endometrio (utero), dell'esofago e della cistifellea, dall’altra parte la perdita di peso volontario può invertire alcuni degli effetti dell’accumulo del grasso, come il rischio di sviluppare il diabete e la malattia cardiovascolare. Anche gli studi dei pazienti sottoposti alla chirurgia bariatrica hanno dimostrato la riduzione dei tassi dei tumori correlati all'obesità.
Pur tuttavia, a differenza dell’associazione tra il consumo del tabacco e il cancro ai polmoni, non c'è ancora una risposta indissolubile e indiscutibile che spieghi chiaramente il collegamento tra l’obesità e il cancro. I numeri del cancro sono, comunque, allarmanti e destinati a peggiorare. Nel 2007, il NCI (National Cancer Institute) ha stimato che 34.000 nuovi casi di cancro negli uomini, il 4% del totale annuo, erano stati causati dall’obesità e nelle donne 50.500, pari al 7% del totale. Pertanto, se l’obesità continua a crescere con i ritmi attuali, il NCI valuta entro il 2030 una proiezione di circa 500.000 nuovi casi di cancro causati dall’obesità.
Il cancro, comunque, è già oggi la seconda causa più comune di morte dopo le malattie cardiache e, aumentando di prevalenza per un tasso di obesità in crescita progressiva, diventerebbe, di certo, nel mondo occidentale il killer numero uno.
L'obesità è oggi, in effetti, per il mondo intero una sfida ardua di salute pubblica e anche gli oncologi devono, quindi, sentire l'obbligo di studiare e apprendere le strategie per ridurre il rischio dei tumori correlati a questa epidemia. Occorrono, per l’appunto, programmi di educazione e aggiornamento per medici e pazienti, ma anche strumenti adeguati per garantire a tutti i pazienti di ricevere le cure migliori e più avanzate.
La restrizione calorica o una dieta che riduca, comunque, l'assunzione totale delle calorie del 20-40%, ha, in effetti, dimostrato di aumentare la longevità in diverse specie animali. Nell’uomo è andato, così, crescendo l’interesse della restrizione calorica come strategia di trattamento delle malattie legate all'età, qual è il cancro.
È bene ricordare, come indicazione di opportuna consultazione, che l'AIOM (Associazione Italiana di Oncologia Medica), l’ESMO (European Society for Medical Oncology) e la NCCN (National Comprehensive Cancer Network) hanno elaborato anche recentemente le linee guida sui tumori.
Rainer J Klement e Ulrike Kämmerer dell’University hospital of Würzburg, Germany hanno discusso sulle evidenze degli ultimi anni derivate dalla riduzione sistematica della quantità dei carboidrati alimentari sulla soppressione, o almeno ritardo della comparsa del cancro e sul rallentamento della proliferazione delle cellule tumorali (Nutrition & Metabolism 2011, 8:75.)
In effetti, la documentazione della rarità di questa temibile malattia nelle società primitive di cacciatori-raccoglitori conduce a considerarla una patologia propria della civiltà e legata alle condizioni evolutive del genere umano. È ragionevole supporre, così, che i fattori di stile di vita, che proteggono il nostro genoma contro la tumorigenesi, sono stati selezionati all'inizio della nostra storia. Peraltro, il periodo successivo alla rivoluzione neolitica, con il passaggio dal foraggiamento e dal nomadismo all'agricoltura e allo stanziamento, si è esteso per una frazione inferiore all'1% della storia dell’uomo. Così, il passaggio dalla dieta del cavernicolo, composta di grassi, carne e solo occasionalmente da radici, bacche e altre fonti di carboidrati, a una nutrizione dominata da zuccheri facilmente digeribili sarebbe avvenuto troppo di recente per indurre le importanti modificazioni nei geni che codificano le tappe metaboliche. Tutto ciò è ancora più vero per quanto riguarda i cambiamenti degli ultimi 100 anni, in particolare quelli riguardanti la transizione dal lavoro nei campi allo stile di vita sedentario con aumento del consumo di cibi facilmente digeribili e assimilabili. Si è giunti, infatti, all’adozione sempre più esasperata della vita occidentale con utilizzo di alimenti con alto indice glicemico e rischio sempre maggiore delle malattie della civiltà.
Per quanto riguarda questi aspetti nutritivi si può considerare che:
- La maggior parte, se non tutte, delle cellule tumorali hanno una forte richiesta di glucosio rispetto alle cellule benigne dello stesso tessuto e svolgono la glicolisi anche alla presenza di ossigeno (effetto Warburg). Inoltre, molte cellule tumorali esprimono gli IRS (insulin receptors) e mostrano l'iperattivazione della via IGF1R-IR. Esistono prove, peraltro, che i livelli cronicamente elevati del glucosio nel sangue, dell’insulina e dell’IGF1 facilitano la tumorigenesi e peggiorano la prognosi nei pazienti oncologici.
- Il coinvolgimento dell'asse glucosio-insulina può spiegare l'associazione della sindrome metabolica con un aumentato rischio per diversi tumori. La restrizione degli zuccheri ha già dimostrato di esercitare effetti favorevoli nei pazienti con sindrome metabolica. Studi epidemiologici e antropologici indicano che limitare gli zuccheri nella dieta potrebbe essere utile per ridurre il rischio del cancro.
- Molti pazienti affetti da cancro, in particolare quelli degli stadi avanzati della malattia, mostrano un alterato metabolismo caratterizzato da un aumento dei livelli plasmatici delle molecole infiammatorie, da un’alterata sintesi del glicogeno, da un aumento della proteolisi, da un maggiore utilizzo del grasso nel tessuto muscolare, da un aumento della lipolisi nel tessuto adiposo e da un’aumentata gluconeogenesi epatica. Peraltro, le diete, a contenuto alto di grassi e basso di zuccheri, mirano a rendere conto delle alterazioni metaboliche. Sta di fatto, che gli studi condotti finora hanno dimostrato che tali diete sono sicure e probabilmente benefiche, in particolare per i pazienti oncologici in fase avanzata.
- La restrizione degli zuccheri imita lo stato metabolico della restrizione calorica o, nel caso di KD (ketogenic diet), del digiuno. In effetti, i ruoli benefici della restrizione calorica e del digiuno sul rischio del cancro e sulla sua progressione sono ben stabiliti. La restrizione dei carboidrati apre, così, la possibilità di indirizzare gli stessi meccanismi di base senza gli effetti collaterali della fame e della perdita di peso.
- Alcuni studi di laboratorio indicano un potenziale diretto anti-tumorale dei corpi chetonici. Infatti, nel corso degli ultimi anni un gran numero di studi sui topi ha dimostrato gli effetti antitumorali della dieta chetogenica per vari tipi di tumore. Peraltro, anche alcuni casi e studi preclinici hanno dimostrato risultati promettenti nei pazienti oncologici. Pertanto, sono state promosse consequenzialmente diverse ricerche cliniche per indagare sul valore della dieta chetogenica, come opzione terapeutica di supporto in oncologia.
Aumento del peso tra i sette rischi principali contro la buona salute
Nel 2010 l'AHA (American Heart Association) ha annunciato l’obiettivo strategico per migliorare la salute entro il 2020 riducendo la morte cardiovascolare e dell’ictus del 20%. Per il raggiungimento di quest’obiettivo il concetto di salute cardiovascolare ideale è stato definito in conformità a sette comportamenti di salute o di fattori, tra cui il fumo, l'attività fisica, l'obesità, la dieta, il colesterolo totale, la pressione arteriosa e la glicemia. Dopo di ciò la ricerca in una varietà di popolazioni ha dimostrato che il soddisfacimento del maggior numero di parametri di salute ideale si associava agli esiti di salute più favorevoli.
In effetti, Folsom AR dell’University of Minnesota, USA e collaboratori con lo studio ARIC (Atherosclerosis Risk In Communities) evidenziavano nei partecipanti di 45-64 anni d'età un forte rapporto graduale tra il numero di metriche di salute ideali al basale e gli incidenti di CVD (cardiovascular disease) per oltre venti anni di follow-up (J Am Coll Cardiol. 2011;57:1690–1696).
Inoltre, Laitinen TT della Preventive Cardiovascular Medicine, Turku, Finland e collaboratori dimostravano nello YFS (Young Finns Study) che il numero d’ideali metriche di salute cardiovascolare presenti nell'infanzia prediceva la successiva salute cardiometabolica nell’adulto (Circulation. 2012 Apr 24;125(16):1971-8).
Infine, Ford ES del Center for Disease Control and Prevention, Atlanta, USA e collaboratori nell’analisi del National Health and Nutrition Examination Survey dimostravano che il numero di metriche ideali incontrato correlava significativamente e inversamente alla mortalità per tutte le cause e per quella cardiovascolare (Circulation. 2012 Feb 28;125(8):987-95).
Pur tuttavia, anche se le metriche di salute individuate dall’AHA Strategic Planning Task Force and Statistics Committee erano state selezionate principalmente per le forti associazioni con le CVD, molte delle stesse, come la dieta, l'attività fisica, il BMI (body mass index) e il fumo, si rivelavano anche fattori di rischio per molti tipi di cancro.
Laura J. Rasmussen-Torvik della Northwestern University Feinberg School of Medicine, Chicago e collaboratori, proprio in conformità a queste associazioni di rischio condiviso, hanno voluto studiare se il numero dei parametri cardiovascolari ideali raggiunti, come definito dalla AHA, fosse significativamente e inversamente associato con l’incidenza del cancro (Circulation. Mar 26, 2013; 127(12): 1270–1275). Gli Autori hanno, così, scelto di condurre quest’analisi nello studio ARIC che conteneva informazioni su entrambi gli incidenti di cancro e di malattie cardiovascolari in un ampio strato di popolazione bi razziale, con coorte geograficamente diversa. Si ottenevano, in tal modo, confronti informali facilitati tra l'associazione delle metriche ideali per la salute cardiovascolare con l’incidente di CVD e di cancro. Si selezionavano, quindi 13.253 partecipanti ARIC, ottenendo misurazioni di base per classificarli in conformità ai sette parametri AHA di salute cardiovascolare.
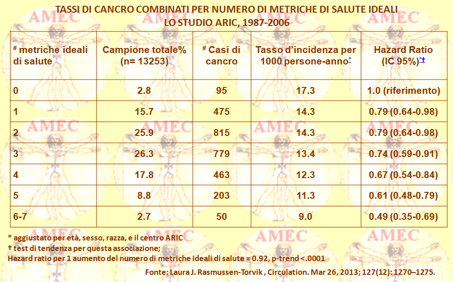
L'incidenza del cancro combinato nel periodo 1987-2006, con esclusione dei tumori della pelle non – melanoma, era rilevata utilizzando i registri tumori e della sorveglianza in ospedale. Nel corso del follow - up occorrevano 2.880 casi di cancro. Si utilizzava, quindi, la regressione di Cox per calcolare gli hazard ratio, rilevando una significativa (p <.0001), graduale associazione inversa tra il numero d’ideali metriche di salute cardiovascolare al basale e l'incidenza del cancro. I partecipanti con 6-7 metriche ideali di salute, il 2,7% della popolazione, avevano il rischio del 51% d’incidenza di cancro più basso rispetto a chi incontrava tali obiettivi allo zero per cento. Quando il fumo era rimosso dalla somma delle metriche di salute ideali, l'associazione si attenuava nei partecipanti con 5-6 metriche di salute con un rischio di cancro inferiore del 25% rispetto a quelli con lo zero metrico (p = 0,03).
In conclusione, l'adesione ai sette parametri di salute ideali, definiti dagli obiettivi AHA 2020, si associava con l'incidenza più bassa del cancro.
Più recentemente Douglas G Manuel dell’University of Ottawa – Canada e collaboratori hanno voluto esaminare le tendenze al 2021 dei fattori di rischio prevenibili in Canada, cui si potrebbero riferire quelle di tutti i Paesi ad alta economia (CMAJO May 20, 2014 vol. 2 no. 2 E94-E101). Dal 2003 al 2009 i rischi previsti di malattia cardiovascolare si basavano sul modello di microsimulazione strettamente approssimata delle indagini nazionali. Fatta eccezione per l'obesità e il diabete, fino al 2021 si delineava una proiezione in diminuzione per tutti gli altri fattori di rischio. Le maggiori riguardavano la diffusione del fumo, dal 25,7% del 2001 al 17,7% nel 2021, e l’ipertensione non controllata, dal 16,1% al 10,8%. In particolare, tra il 2015 e il 2017, l'obesità come fattore di rischio prevalente in proiezione, superava il fumo.
World Health Statistics 2014 e aspettativa di vita alla nascita
Secondo la World Health Statistics 2014, pubblicata dall'OMS (Organizzazione mondiale della sanità) il 15 maggio e basata sulle medie globali di 194 paesi, si vive più a lungo in tutte le parti del globo. Pur tuttavia, si rileva ancora un grande divario tra le popolazioni ricche e quelle povere con le prime che continuano ad avere molte più possibilità di vivere più a lungo rispetto alle seconde. Peraltro, ovunque le donne vivono più degli uomini con un divario di circa sei anni nei paesi ad alto reddito. Nei paesi a basso reddito, la differenza è, invece, di circa tre anni. L’Italia si colloca nella classifica mondiale stilata dall’OMS sull’aspettativa di vita al 7° posto per quanto riguarda gli uomini e al 5° per le donne.
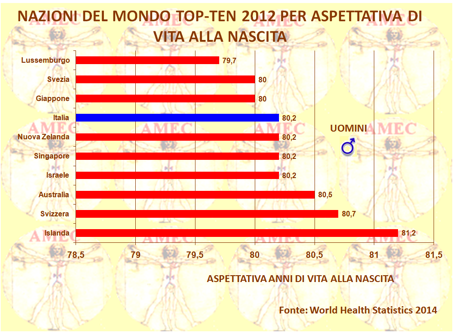
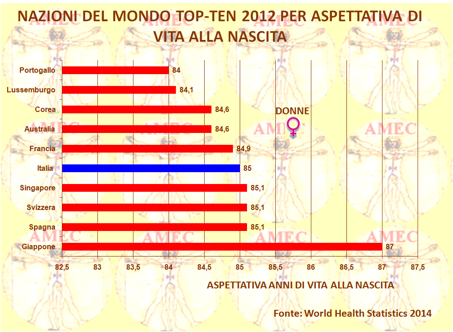
Nel documento si afferma che nei paesi ad alto reddito gran parte del guadagno della speranza di vita si deve al successo della lotta contro le malattie non trasmissibili. Difatti, un sempre minor numero di persone d’ambo i sessi muore prima dei sessanta anni per le malattie cardiache e per l’ictus. In effetti, nei paesi economicamente più ricchi il controllo e la gestione dei fattori di rischio hanno permesso un aumento progressivo dell’aspettativa di vita, mentre in quelli in via di sviluppo, come l’Angola, la Repubblica Centroafricana, il Ciad, la Costa d'Avorio, la Repubblica Democratica del Congo, il Lesotho, il Mozambico, la Nigeria e la Sierra Leone, i valori sono ancora inferiori ai cinquantacinque anni.
In tutto il mondo, comunque, sta avvenendo un grande cambiamento nei riguardi delle cause e dell’età di morte. La malattia coronarica, le infezioni delle vie respiratorie inferiori e l’ictus sono le prime tre cause di morte prematura.
In ventidue paesi dell’Africa il 70% o più di anni di vita persi per morti premature è dovuto alle malattie infettive e alle patologie correlate. Le malattie croniche e le lesioni, d’altro canto, causano oltre il 90% degli anni di vita persi in quarantasette paesi, quasi tutti ad alto reddito, e stanno costituendo la principale causa di decessi in più di 100 nazioni. Interessante è notare come nel 2012 circa quarantaquattro milioni dei bambini di tutto il mondo di età inferiore ai cinque anni, pari al 6,7%, erano in sovrappeso o obesi e che dieci milioni di essi erano in Africa, dove i livelli dell’obesità infantile sono rapidamente aumentati.
In definitiva il rapporto concludeva che la grande sfida che attendeva i sistemi sanitari mondiali era costituita dall’invecchiamento demografico con il suo carico di cronicità, di malattie trasmissibili, di stili di vita. Perciò la prevenzione e l’equità di accesso ai sistemi di cura erano condizioni prioritarie da risolvere.
In Italia l’aumentata incidenza del tumore è in parte spiegabile con l’invecchiamento della popolazione e in parte attribuibile alle cause ambientali. Pur tuttavia, per questa patologia si deve registrare un aumento dei tassi di guarigione dovuto fondamentalmente alla diagnosi precoce e alle terapie anti-tumorali sempre più efficaci. Il rapporto dell’Associazione Italiana Registri Tumori (Airtum) del 2013 riporta nel nostro Paese circa 366.000 nuove diagnosi di tumore ogni anno, di cui 200 mila negli uomini e 166.000 nelle donne. Pur tuttavia, le percentuali di sopravvivenza a cinque anni dalla diagnosi sono del 55% per gli uomini e del 63% per le donne. Nell’uomo i tumori più frequenti sono con il 20% quello della prostata, con il 15% quello del polmone e con il 14% quello del colon retto. Nella donna il più comune con il 29% è quello della mammella e di seguito con il 14% quello del colon retto e con il 6% quello del polmone, la cui incidenza è aumentata negli ultimi decenni per la sempre più diffusa abitudine al fumo di sigaretta in questo sesso. Il World Cancer Report 2014 riporta, peraltro, che le morti per cancro tra gli stranieri residenti in Italia sono state superiori del 20% rispetto agli italiani, probabilmente per una carenza dell’azione preventiva.
Obesità e cancro al seno
Ogni anno, nel mondo 450.000 donne muoiono a causa del tumore al seno e circa il 15-20% di quelle colpite ha una forma Her2 positiva. Studi epidemiologici hanno identificato numerosi fattori di rischio che nella donna sono in grado di aumentare la probabilità di sviluppare la malattia e molti di essi sono utilizzati dagli studiosi per modellare la base degli strumenti di valutazione del rischio stesso. Il loro comune denominatore è, peraltro, definito dal loro effetto sul livello e sulla durata dell'esposizione agli estrogeni endogeni.
Sotto quest’aspetto, bisogna ricordare che l'obesità è un problema crescente di salute in tutto il mondo e che il peso corporeo in eccesso è ormai collegato a un aumentato rischio di carcinoma mammario in post-menopausa. Peraltro, vi è anche una crescente evidenza che l'obesità si associ alla prognosi infausta nelle donne con diagnosi di cancro al seno in fase iniziale. Diversi studi, infatti, avrebbero dimostrato che le donne, in sovrappeso o obese al momento della diagnosi del cancro al seno, presenterebbero un aumentato rischio di ricorrenza del cancro e di morte rispetto alle donne più magre. Altre evidenze suggerirebbero che le donne, con aumento del peso dopo la diagnosi di cancro al seno, avrebbero anche un aumentato rischio di scarsi risultati.
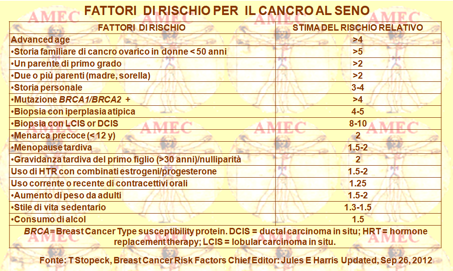
È da notare che il menarca precoce, la nulliparità, la HRT (hormone replacement therapy) e l'obesità in postmenopausa hanno effetti sugli estrogeni. Peraltro, l'aumento del rischio nelle donne obese è probabilmente dovuto alla conversione degli androgeni in estrogeni nel tessuto adiposo.
Pur tuttavia, il dato che l’obesità nelle donne in premenopausa rappresenta un rischio ridotto può concernere le società industrializzate ed essere applicabile solo alle obese più giovani. Peraltro, il rischio più elevato si è rilevato soprattutto nelle donne che non hanno mai utilizzato la terapia ormonale in menopausa e per i tumori che esprimono i recettori sia per gli estrogeni sia per il progesterone. Pur tuttavia, in alcuni studi il sovrappeso e l'obesità sono stati, invece, trovati in correlazione con un ridotto rischio in premenopausa.

Per altro conto, il ruolo del consumo di frutta e verdura, come modificatori alimentari del rischio del cancro al seno, è stato studiato sin dalla metà del secolo scorso. Pur tuttavia, nonostante le varie ipotesi avanzate sui meccanismi protettivi di questi alimenti, i risultati degli studi sono stati contraddittori e solo suggestivi di protezione per la malattia in premenopausa. Allo stato delle conoscenze attuali, si può affermare più semplicemente che una maggiore assunzione selettiva di frutta e verdura può essere efficace per la prevenzione e cura della malattia.
Peraltro, le pazienti affette da tumore della mammella tendono nel primo anno di trattamento a un aumento ponderale pari a circa 5 Kg. Tutto ciò sia per gli steroidi assunti per contrastare gli effetti indesiderati della chemioterapia, sia come evento collaterale della terapia anti-ormonale nel caso di positività ai recettori ormonali. In effetti, sono ormai diversi gli studi che dimostrano come un aumento di peso rappresenta un problema per le pazienti oncologiche, perché, tra l’altro, rende meno efficaci i trattamenti. Per questo nel corso di queste terapie è così importante avere un occhio di riguardo per il metabolismo.
Particolare interesse hanno suscitato i TNBC (triple-negative cancers), che rappresentano circa il 20% delle neoplasie maligne della mammella e che sono caratterizzati dalla mancanza di recettori ormonali, da una particolare aggressività, da una prognosi severa con recidive e corti intervalli di ricorrenza. Per il loro controllo sono usati comunemente diversi agenti antitumorali, come anche l’IR (ionizing radiation), ma con risultati inconsistenti e incompleti. Peraltro, le pazienti possono rispondere bene alle terapie standard, oppure essere completamente resistenti o avere precoci recidive. Pertanto, l’identificazione dei TNBC è utile per il programma di nuovi target terapeutici che possano assicurare una risposta migliore alle cure. In tale contesto, diversi studi avrebbero dimostrato che, combinando due differenti inibitori contro lo stesso target molecolare, si potrebbe ottenere una maggiore efficacia terapeutica. Pur tuttavia, le ricerche in tal senso sono limitate dalla tossicità degli agenti utilizzati. Pertanto, come approccio alternativo, sono allo studio strategie che possano ridurre il processo globale dell’attività del tumore. La CR (caloric restriction), con il ridurre l’assunzione alimentare di circa il 20-30%, è una forma ricercata in tale merito. Essa ha dimostrato, in effetti, di indurre mutamenti nelle diverse parti dei processi di manifestazione del cancro, secondo una modalità interessante da esplorare, senza per questo aggiungere tossicità. Vi sono state evidenze, a tal proposito, che la CR, in combinazione con l’IR, abbia promosso una regressione additiva del tumore.
Weiderpass E del Karolinska Institutet, Stockholm, Sweden e collaboratori, ritenendo scarse le informazioni sull’associazione tra cancro al seno in premenopausa e le dimensioni del corpo durante l'infanzia e l'adolescenza, dal 1991 al 1992 hanno svolto uno studio prospettico di coorte in Norvegia e Svezia (Cancer Epidemiol Biomarkers Prev. 2004 Jul;13(7):1121-7). Sono state incluse nell'analisi 99.717 donne in premenopausa con un follow-up conclusosi nel dicembre 1999. Tra le partecipanti 733 sviluppavano un tumore primario invasivo al seno. Il sovrappeso e l’obesità [indice di massa corporea (BMI)> 25 kg / m2] al momento dell'arruolamento si associavano a un ridotto rischio di cancro premenopausale al seno (P = 0.007). Le apparenti associazioni tra la forma del corpo percepita a sette anni e l’indice di massa corporea all'età di diciotto, con corporatura più pesante a entrambe le età, apparentemente protettive per il rischio di cancro al seno in premenopausa, perdevano la loro significatività statistica dopo aggiustamento per la BMI al momento dell'arruolamento di coorte. La dimensione corporea all'età di sette anni correlava con la BMI all'età di diciotto (r = 0.43), mentre la BMI a diciotto era in relazione con la BMI da adulto (r = 0,48). Le variazioni delle dimensioni del corpo, a sette anni o a diciotto sino all'età adulta, non influenzavano il rischio di per sé di cancro al seno in premenopausa. L’altezza era legata al rischio, con una riduzione differenziale statisticamente significativa del 30% del rischio solo nelle donne più basse di 160 cm, rispetto a quelle più alte. La diminuzione del rischio di cancro al seno in premenopausa si osservava nelle donne in sovrappeso e obese, senza storia familiare per la malattia, ma non in quelle con positività.
Pur tuttavia, l'aumento del peso in età adulta era stato più volte anche indicato come un fattore determinante del rischio di cancro al seno.
Wayne SJ dell’University of New Mexico, USA e collaboratori, per quantificare il cambiamento di assunzione di chilocalorie, macronutrienti e porzioni di frutta e verdura dopo la diagnosi di cancro al seno e per correlare questi stessi cambiamenti con le caratteristiche del soggetto e la modificazione globale dei modelli alimentari auto-riferiti, hanno arruolato duecentosessanta donne del New Mexico con cancro al seno, recentemente diagnosticato tra il luglio 1997 e il marzo 1999 (J Am Diet Assoc. 2004 Oct;104(10):1561-8). Gli Autori hanno rilevato modesti risultati di cambiamento nella dieta nella diagnosi del cancro al seno. Le piccole variazioni nel consumo di frutta e verdura suggerivano agli Autori che si sarebbero dovuti dedicare sforzi maggiori per incoraggiare in queste malate un maggiore consumo di questi alimenti.
Margot P. Cleary e Michael E. Grossmann dell’University of Minnesota, considerando la sostanziale evidenza che l’aumento di peso rappresenta un fattore di rischio importante per lo sviluppo del cancro al seno, soprattutto ormone-sensibile in post-menopausa, capace di determinare anche un impatto negativo sulla prognosi della malattia sia in premenopausa sia in postmenopausa, hanno descritto i possibili meccanismi di tumorigenesi mammaria (Endocrinology. 2009 June; 150(6): 2537–2542.). In effetti, gli elevati livelli degli estrogeni nel sangue, come quelli prodotti localmente, sono stati considerati i mediatori primari degli effetti dell’aumento del peso corporeo sullo sviluppo del cancro al seno nelle donne in postmenopausa. Inoltre, le adipochine, sintetizzate direttamente nel tessuto adiposo, sono state indicate come capaci di influenzare questo sviluppo di malattia influendo sia sui livelli circolanti e sia sulla produzione locale di queste sostanze. Gli Autori nella loro panoramica descrittiva hanno discusso, quindi, il rapporto degli estrogeni sia con l'obesità, sia con il cancro al seno, come entità separate, citando studi importanti e altri fattori di crescita che potevano essere coinvolti in questa relazione.
Healy LA dello St James's Hospital and Trinity College Dublin, Ireland e collaboratori, proprio in virtù dell’associazione tra l'obesità e l’aumentato rischio di cancro al seno in post-menopausa, ma anche dei tassi di mortalità senza ben chiari meccanismi determinanti hanno arruolato 105 donne in postmenopausa con carcinoma mammario di nuova diagnosi (Clin Oncol (R Coll Radiol). 2010; 22(4):281-8). Hanno, così, redatto una dettagliata storia clinica e un’analisi della composizione corporea, dei dati metabolici e della misura delle adipochine e dei marcatori infiammatori. L'età media delle partecipanti era di sessantotto anni, con valori dai quaranta ai novantaquattro anni, e la media dell'indice di massa corporea era 28,3 + / -5,2 kg/m2, con l'87% di obese di tipo centrale. La sindrome metabolica era diagnosticata nel 39% dei casi ed era significativamente associata con l’obesità centrale (P <0,005) e una maggiore infiammazione [livelli di PCR doppi nelle pazienti con sindrome metabolica rispetto a quelle non affette (10.3 vs 5.8 mg / l, P = 0,084)]. Peraltro, le pazienti con una fase patologica successiva (II-IV) presentavano probabilità significativamente maggiori di essere affette da un’obesità generale (P = 0,007), di tipo centrale (P = 0.009), con iperglicemia (P = 0,047) e con iperinsulinemia (P = 0.026). Il 51% aveva la sindrome metabolica, rispetto al 12% con malattia in stadio precoce. I casi con linfonodi positivi alla malattia avevano probabilità significativamente maggiori di essere iperinsulinemici (P = 0,030) e con sindrome metabolica (p = 0.028), rispetto a quelli con linfonodi negativi per la malattia.
I dati, pertanto, suggerivano che la sindrome metabolica e l’obesità centrale erano comuni nelle pazienti con cancro al seno in postmenopausa. Inoltre, la sindrome metabolica poteva essere associata a una biologia tumorale più aggressiva.
Di certo interesse è la revisione riportata da Rowan T Chlebowski del Los Angeles Biomedical Research Institute sulla base d’indagini precliniche e di selezionati studi osservazionali a supporto di un'associazione tra maggiore assunzione di vitamina D e 25-idrossivitamina D con la riduzione del rischio di cancro al seno (Breast Cancer Research 2011, 13:217). Pur tuttavia, l’Autore ha dovuto concludere che le evidenze erano incoerenti e insufficienti per una raccomandazione tassativa nutrizionale. Le evidenze correnti supportavano, difatti, che la necessità di supplementazione di 25-idrossivitamina D dovesse attuarsi in casi studiati a proposito e non in forma routinaria.
Ewertz M dell’Odense University Hospital, Denmark e collaboratori hanno voluto eseguire uno studio per caratterizzare l'impatto dell'obesità sul rischio di recidiva del carcinoma mammario e sulla mortalità (J Clin Oncol. 2011; 29(1):25-31). Su 18.967 donne con noto indice di massa corporea, trattate per cancro al seno in fase iniziale in Danimarca tra il 1977 e il 2006 con follow completo, rilevavano che l'obesità era un fattore prognostico indipendente per lo sviluppo di metastasi a distanza e di morte. Inoltre, gli effetti della terapia adiuvante sembravano disperdersi più rapidamente nelle pazienti obese con cancro al seno.
Yong Heng Yaw dell’Universiti Putra Malaysia e collaboratori, considerando che l'aumento del peso, piuttosto che la sua perdita, si verificava spesso dopo la diagnosi di cancro al seno nonostante le modifiche dello stile di vita salutari adottate dalle superstiti, hanno voluto descrivere la prevalenza e l'entità delle variazioni antropometriche prima e dopo la diagnosi della malattia, prendendo in esame anche i comportamenti di stile di vita in 368 malate (BMC Public Health 2011, 11:309).
Dopo la diagnosi di cancro al seno l'aumento del peso era evidente in questo campione di donne. Così che le informazioni sulla grandezza del cambiamento corporeo con i vari gradi di variazione del peso e degli stili di vita delle superstiti dopo la diagnosi della malattia, secondo gli Autori, avrebbero potuto facilitare lo sviluppo e la destinazione delle strategie d’intervento efficaci per raggiungere il peso sano e la salute ottimale per una migliore sopravvivenza.
Haakinson DJ della Mayo Clinic Arizona e collaboratori hanno svolto una revisione retrospettiva delle pazienti trattate in un unico centro sin dal 2000-2008, mettendo a confronto due gruppi: non obese con indice di massa corporea <30 e obese con indice di massa corporea ≥ 30. Su un totale di 1.352 pazienti il 76% era con obesità e il 24% con peso normale (Ann Surg Oncol. 2012 Sep;19(9):3012-8). Nel confronto per età le obese erano meno frequentemente più giovani dei cinquanta anni, rispetto alle non obese, con un rapporto del 10% contro il 90%. Nel confronto, invece, sopra i cinquanta anni vi era un rapporto del 18%, vs l’82%, p = 0.0019. Peraltro, le obese avevano una maggiore probabilità di diagnosi con il rilievo di studio per immagini, rispetto alle non obese (67% vs 56%, p = 0,0006). Inoltre, le obese presentavano tumori di dimensioni maggiori (1,7 centimetri vs 1,4 cm, P <0.001) e un maggior tasso di linfonodi (LN) metastatici (31% vs 25%, P = 0,026). All'analisi multivariata, l'obesità si associava ai tumori non palpabili e più grandi, a una maggiore incidenza di metastasi LN, a una minore incidenza di positività HER2, a una minore incidenza di multifocalità e a una minore suscettibilità di essere oggetto di ricostruzione dopo la mastectomia.
In conclusione, i dati degli Autori dimostravano che le pazienti obese presentavano, rispetto alle normali di peso, la malattia già clinica alla mammografia in età più tarda e con il cancro in fasi più avanzate. Da ciò, secondo gli studiosi sarebbe derivato il suggerimento di promuovere tra la popolazione delle obese in forma molto pressante le strategie di screening.
Eichholzer M dell’University of Zurich Switzerland e collaboratori, considerando che la popolazione svizzera femminile si distingueva per i bassi tassi di obesità / sovrappeso rispetto agli altri paesi occidentali e che gli stessi erano stabili da più di dieci anni, hanno voluto analizzare l’eccesso ponderale in pazienti con cancro al seno di 51-80 anni, con iniziale diagnosi tra il 1990 e il 2009 (Arch Gynecol Obstet. 2012; 285(3):797-803). I dati erano ricavati dal BBCD (Basel Breast Cancer Database) e poi confrontati con quelli di donne della stessa età delle SHS (Swiss Health Surveys), condotte tra il 1992 e il 2007. Delle 958 pazienti del BBCD in post-menopausa il 32% era in sovrappeso e il 20% con obesità. Delle 14.476 donne delle SHS il 38% era in sovrappeso e il 17% con obesità. Nel BBCD nel corso degli ultimi venti anni non vi era alcun cambiamento di prevalenza del sovrappeso / obesità. Le quattro SHS mostravano, invece, una curvatura convessa per l'obesità, cioè un aumento transitorio. Non si osservavano, comunque, in questo periodo differenze significative tra i dati corretti del BBCD e delle SHS per il sovrappeso e l'obesità.
In conclusione, in questo gruppo di studio svizzero, con una prevalenza relativamente bassa di sovrappeso e obesità, non si osservava alcuna associazione tra il grasso corporeo e il cancro al seno in postmenopausa.
Sparano, J. A. dell’Albert Einstein College of Medicine, New York e collaboratori hanno inteso valutare la relazione tra l’indice di massa corporea e i risultati dei sottotipi di cancro al seno (Cancer, 2012, 118: 5937–5946). In una popolazione di studio clinico che escludeva le pazienti con comorbidità significative, l'obesità era associata con i risultati inferiori. Tutto ciò, in particolare, era evidente nelle pazienti con carcinoma mammario operabile, positive per il recettore ormonale, trattate con la chemioterapia standard e ormonale.
Su-Hsin Chang della Washington University School of Medicine e collaboratori hanno voluto valutare negli Stati Uniti l’influenza dell’obesità sulla mortalità e sull'aspettativa di vita delle donne con cancro al seno (Prev Chronic Dis 2013;10:130112). Hanno, così, utilizzato i dati del National Health Interview Survey 1997-2000, comprendendo donne non fumatrici e non gravide con un indice di massa corporea di almeno 18,5 kg/m2 e nessun cancro diverso dal tumore al seno al momento dell'indagine. Il numero di anni di vita persi per il cancro al seno era più marcato per le donne più obese. Quelle sotto i cinquanta anni e quelle di settanta o più anziane mostravano anche un maggior numero di anni persi rispetto a quelle di età compresa tra i cinquanta e i sessantanove anni.
Pertanto, secondo gli Autori le iniziative di salute pubblica dovrebbero porre maggiormente l'accento sulla prevenzione e il controllo dell’obesità per queste popolazioni più colpite.
Katherine Esposito della Second University of Naples, Italy e collaboratori, non considerando ancora poco chiaro il ruolo della SM (metabolic syndrome) e dei suoi singoli componenti nel rischio del PBC (postmenopausal breast cancer), hanno esaminato e riassunto gli studi epidemiologici sull'associazione delle due condizioni (Menopause. 2013;20(12):1301-1309). In conformità a una ricerca elettronica, senza limiti per articoli pubblicati prima del 31 ottobre 2012, hanno riportato le stime di rischio con il 95% di IC per l'associazione tra SM e PBC. S’includevano nella meta-analisi nove articoli con 6.417 casi di cancro, tutti pubblicati in inglese. La MS si associava con un aumento del 52% nel rischio del cancro (P <0,001). Il dato era per lo più confinato agli studi non di coorte (109% di aumento del rischio). Le stime di rischio cambiavano di poco secondo le popolazioni (Stati Uniti o Europa) e della definizione della sindrome (tradizionale vs non tradizionale). Le stime del rischio per PBC erano 1.12 (P = 0.068) per i valori più alti della BMI/ circonferenza vita, 1.19 (P = 0.005) per l’iperglicemia (alto glucosio a digiuno o diabete), 1.13 (P = 0,027) per la più alta pressione sanguigna, 1.08 (P = 0.248) per i trigliceridi alti, e 1.39 (P = 0.008) per le HDL. Tutte queste stime erano inferiori a quelle associate con la SM negli stessi studi.
In conclusione, la MS si associava con un rischio moderatamente aumentato di PBC. Nessun singolo componente, però, spiegava il rischio veicolato dalla sindrome completa.
Hongchao Pan dell’University of Oxford in the United Kingdom e collaboratori hanno presentato i risultati di uno studio all’Annual Meeting ASCO (American Society Of Clinical Oncology) 2014, basato sui dati dei pazienti di settanta studi clinici, utilizzando l'analisi di regressione di Cox per valutare come il BMI (body mass index) di una paziente potesse influire in maniera indipendente sulla peggiore prognosi del cancro mammario in fase iniziale (J Clin Oncol. 2014, suppl; abst 503.) Delle 60.000 pazienti dello studio con tumore ER-positivo l'obesità si associava a un aumento della mortalità per cancro al seno, indipendentemente dallo stato menopausale (2P <0,00001). Tuttavia, dopo aggiustamento per le caratteristiche del tumore, per 20.000 di queste pazienti in premenopausa il tasso di mortalità era superiore di un terzo nelle donne obese, rispetto alle loro controparti di peso normale che avevano un BMI = 20-25 kg/m2 (rischio relativo [RR] = 1,34, IC 95%: 1,22-1,47; 2P <0,00001), con esiti più gravi e trend costantemente in rapporto agli alti livelli del BMI. Gli Autori rilevavano anche uno scarso effetto indipendente dell’obesità nelle 40.000 donne in postmenopausa con malattia ER-positiva (RR = 1.06, IC 95%, 0,99-1,14; 2P = .12). Vi era anche un aumento del 21,5% in dieci anni del rischio di mortalità del cancro al seno per il sottogruppo in premenopausa. Le pazienti ER-positive obese, rispetto al rischio del 16,6% delle loro controparti di peso normale, mostravano una differenza del 5% (IC, 3,0-6,8).
Pan, commentando che l'obesità aumentava notevolmente i livelli di estrogeni nel sangue solo nelle donne in postmenopausa, si dichiarava sorpreso dei risultati negativi dell'obesità nelle donne in premenopausa. Si doveva, infatti, evincere da tutto ciò che non si era ancora in grado di comprendere in pieno i principali meccanismi biologici con cui l'obesità colpisce la prognosi del tumore.
Mia M. Gaudet dell’American Cancer Society in Atlanta e collaboratori, considerando l’alto indice di massa corporea (BMI) fattore di rischio per il cancro al seno dopo la menopausa, non ritenendo abbastanza chiaro nei meriti il ruolo della circonferenza vita, hanno seguito per una media di 11,58 anni 28.965 donne in postmenopausa, senza terapia ormonale sostitutiva, rilevando il loro peso e il giro vita su un questionario del 1997 (Cancer Causes & Control June 2014, Volume 25, Issue 6, pp 737-745).
I ricercatori durante il follow-up identificavano 1.088 casi di carcinoma mammario invasivo. Una circonferenza vita più grande si associava senza aggiustamento per il BMI a un aumentato rischio del carcinoma mammario (hazard ratio per 10 cm di aumento della circonferenza vita, 1.13; intervallo di confidenza al 95%, 1,08-1,19). La correlazione scompariva dopo aggiustamento per l’indice di massa corporea (rapporto di rischio per 10 cm di aumento della circonferenza vita, 1.00, IC 95%, 0,92-1,08). Il BMI era significativamente associato con il rischio, prima e dopo aggiustamento per la circonferenza della vita (hazard ratio per 1 kg / m², 1.04 [IC 95%, 1,03-1,05] e 1.04 [IC 95%, 95, 1,02-1,06], rispettivamente).
In conclusione, i dati secondo gli Autori supportavano il valore di misurazione del BMI per catturare l'aumento del rischio di cancro al seno in postmenopausa associato alle dimensioni corporee più grandi.
Più grande era la circonferenza della vita, maggiore era il rischio di carcinoma mammario in postmenopausa, ma non oltre il suo contributo all'indice di massa corporea (BMI).
Lianjin Jin della Thomas Jefferson University e collaboratori hanno cercato di determinare (Breast Cancer Research and Treatment, 2014; DOI: 10.1007/s10549-014-2978-7) se l'interazione molecolare tra la CR (Caloric Restriction) e l’IR (Ionizing Radiation) potesse essere mediata dal miR (microRNA).
I microRNA, che regolano altri geni nella cellula e specificamente il miR 17 e 20, diminuiscono maggiormente nei topi trattati sia con radiazioni sia con la restrizione calorica. Questa diminuzione, a sua volta, aumenta la produzione delle proteine coinvolte nel mantenimento della matrice extracellulare. La restrizione calorica favorisce i cambiamenti epigenetici nel tessuto mammario che mantengono forte la matrice extracellulare con una sorta di gabbia intorno al tumore, rendendo più difficile per le cellule neoplastiche di sfuggire e diffondersi in altre parti del corpo.
Comprendere il collegamento per il miR 17 offrirebbe anche ai ricercatori un bersaglio molecolare per la diagnosi di quei tumori che hanno maggiori probabilità di metastasi. Peraltro, offrirebbe una maggiore potenzialità per lo sviluppo di un nuovo farmaco antineoplastico. In effetti, teoricamente un farmaco che possa diminuire il miR 17 potrebbe avere lo stesso effetto sulla matrice extracellulare, come la restrizione calorica. Tuttavia, il targeting di un unico percorso molecolare, come quello del miR17, dovrebbe essere improbabilmente efficace come la restrizione calorica. In particolare, nelle cellule tumorali affamate, si ridurrebbe la concentrazione dei microRNA 17 e 20 (miR 17/20), che di norma sono, invece, abbondantemente espressi nei TNBC (triple-negative breast cancer) metastatizzati. Questi tendono, in effetti, a essere da paziente a paziente geneticamente molto diversi e se la restrizione calorica fosse efficace nelle donne, quanto lo è nei modelli animali, allora probabilmente si potrebbe cambiare il pattern di espressione di un ampio set di geni e colpire senza tossicità bersagli multipli in una sola volta.
Gli Autori hanno condotto la loro ricerca su topine affette da tumore mammario e tenute a restrizione calorica del 30% delle calorie consumate abitualmente. Questa dieta forzata induceva una riduzione delle concentrazioni intracellulari di alcuni microRNA che, secondo gli Autori, avrebbe rappresentato il meccanismo patogenetico di questo effetto anti-tumorale. La dieta ipocalorica avrebbe, in effetti, attivato un particolare programma epigenetico, ostacolando la diffusione del tumore.
Obesità e cancro della prostata
Il cancro della prostata è diventato di diagnosi talmente frequente da stimolare continuamente gran parte della ricerca scientifica verso la comprensione e il chiarimento dei suoi fattori eziologici e d’insorgenza per poterli impedire o ritardare. L'invecchiamento è, di certo, il principale fattore di rischio di sviluppo e progressione della malattia. Pur tuttavia, la dieta e la nutrizione devono giocare un ruolo importante, come nel caso di altri tumori. La possibilità di prevenire o influenzare la crescita del cancro è stata, difatti, avanzata e studiata sin dai primi anni del 1900 e diversi studi in modelli animali hanno indicato che il tasso di crescita cellulare può essere influenzato dal tipo della dieta consumata.
Peraltro, il cancro della prostata, come altri tumori, è un processo molto complesso, per cui nessun singolo fattore potrebbe spiegarne le sue varie sfaccettature.
I fattori dietetici con un ruolo eziologico includerebbero, comunque, l’eccessiva assunzione di grassi, l'obesità, l'eccessiva assunzione di estrogeni e di fitoestrogeni e il consumo di alimenti bruciati o carbonizzati.
Particolare attenzione hanno ottenuto gli acidi grassi insaturi omega-6 e omega-3. In base ai risultati degli studi epidemiologici e sperimentali sugli animali, questi ultimi, come potenti antiossidanti, hanno dimostrato un effetto benefico nello sviluppo del cancro alla prostata.
Anche l'associazione tra la carne e il cancro della prostata è stata particolarmente evidenziata, soprattutto nelle condizioni delle forme lavorate e cucinate o carbonizzate a temperature elevate, come salsicce e pancetta. In effetti, i tempi più lunghi di cottura, le alte temperature, le grigliate e le fritture di tali carni, soprattutto se rosse, producono grandi quantità di composti come le ammine eterocicliche, come la PhIP (2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine) e N-nitrosammine, aggiunte alla lista dei potenziali cancerogeni.
Inoltre, studi epidemiologici hanno indicato per il selenio un potenziale potere preventivo sul cancro della prostata con diminuzione anche del tasso di crescita delle cellule tumorali. In effetti, i livelli plasmatici, sierici e tissutali di questo elemento chimico sono inversamente associati al rischio di sviluppare il cancro alla prostata. Il selenio, com’è noto, è un oligoelemento essenziale, non metallico, ampiamente distribuito in tutto il corpo umano e attivo in varie funzioni come componente di diversi enzimi antiossidanti. Esso si trova in diversi alimenti di derivazione animale e vegetale e in quest’ultimo caso la sua concentrazione dipende dal terreno in cui cresce la pianta.
In quest’ordine di fatti, è interessante notare che l'introduzione delle diete occidentali in Giappone, dove la tradizionale dieta è povera di grassi, ha portato a un aumento dell'incidenza del cancro aggressivo alla prostata. D’altro canto, la correlazione tra obesità e cancro della prostata è stata anche suggerita dagli studi sulla sindrome metabolica. Difatti, in questa condizione che raggruppa adiposità centrale, ipertensione, dislipidemia ed elevati livelli di glucosio nel siero, si è documentata una maggiore incidenza del cancro alla prostata.
A tal proposito, una teoria interessante deriva dal ruolo dell’insulina nella promozione del cancro. L'insulina è, difatti, un importante fattore di crescita e i livelli del fattore di crescita e del suo recettore hanno dimostrato di essere elevati nei malati con cancro della prostata. Pertanto, mantenere bassi i valori dell’insulina può ritardare il tasso di crescita delle cellule tumorali della prostata e tale risultato può essere raggiunto solo attraverso la dieta. Pur tuttavia, sebbene l’alimentazione debba sicuramente giocare un ruolo nello sviluppo del cancro alla prostata, non è stata ancora indicata la dieta specifica per prevenire o sradicare questa malattia.
Il messaggio principale sino a oggi derivato dagli studi nutrizionali sull’uomo è stato, comunque, il beneficio di una dieta principalmente composta di ortaggi, frutta, cereali e pesce in combinazione con un apporto limitato di calorie e con l'esercizio fisico. In effetti, tale tipo di dieta fornisce più micronutrienti, confezionati insieme nella loro forma più efficace, fornendo fibre, ferro, vitamine e antiossidanti. I micronutrienti derivati dagli integratori, invece, sono di solito prodotti per sintesi isolatamente.
Per altro canto, i fattori non dietetici che giocano un ruolo eziologico nel cancro della prostata includono varie alterazioni ormonali, una predisposizione genetica e l’infiammazione cronica. In tale ultimo caso i danni prodotti al DNA (oxidative deoxyribonucleic acid) e l'incapacità di correzione o eliminazione da parte dei vari meccanismi di riparazione funzionanti correttamente come il GSTpi (glutathione S -transferase P1-1) trovato inattivo nei portatori del cancro, sono decisivi.
Inoltre, l’infiammazione prostatica si associa allo stress ossidativo che stimola la produzione di ROS (reactive oxidative species) e RNS (reactive nitrogen species). Questi si legano al DNA e causano le mutazioni. Lo stress ossidativo, derivato da fonti endogene ed esogene, si associa poi ulteriormente ai danni del DNA, derivati dall'invecchiamento, e svolge il suo ruolo nella carcinogenesi. Peraltro, gli acidi grassi polinsaturi inducono la produzione di ROS causando la formazione di radicali lipidici che possono produrre ancora danni al DNA.
Inoltre, lo sperma può anche rivestire un ruolo ossidativo a causa della presenza occasionale di leucociti e una notevole quantità di acidi grassi polinsaturi. Da notare che sono stati identificati diversi meccanismi in grado di prevenire e riparare il danno ossidativo. In effetti, gli enzimi antiossidanti, come la fosfolipasi acida A- 2 che rimuove i grassi, i ROS e gli RNS alterati, evitano le mutazioni. Tutto ciò, in effetti, da una parte rappresenta un esempio degli effetti benefici degli antiossidanti dietetici e dall’altra dimostra che il consumo dei cibi che promuovono la produzione di ROS e RNS dovrebbe essere limitato o completamente evitato.
Dimitropoulou P dell’University of Cambridge e collaboratori, notando che l'obesità era stata collegata alla mortalità per cancro della prostata, ma non con la sua incidenza, hanno svolto, per loro parte, uno studio nei meriti (Br J Cancer. 2011 Mar 1;104(5):875-81). Tra il 2001 e il 2008 hanno, così, arruolato 2.167 casi e 11.638 controlli, selezionati in modo casuale con misure dello PSA. La BMI era classificata nelle condizioni di: minore di 25,0, da 25,0 a 29,9 e maggiore o uguale a 30,0 kg/m2. Dopo aggiustamento per l'età e la storia familiare di cancro alla prostata, gli Autori trovavano poche evidenze di associazione tra la BMI e il cancro alla prostata (odds ratio (OR) tra il più alto vs il più basso terzile: 0,83, intervallo di confidenza 95% (IC): 0,67, 1,03; P 0.1). Una debole associazione inversa era evidente per il basso grado del cancro alla prostata (OR del più alto vs il più basso terzile: 0,76, IC 95%: 0,59, 0,97; P 0,045). Non si rilevava anche alcuna associazione tra la circonferenza vita (OR del più alto vs il più basso terzile: 0,94, IC 95%: 0,80, 1,12;) o il rapporto vita-fianchi (WHR, OR del più alto vs terzile più basso: 0,93, IC 95%: 0,77, 1,11;) con il cancro della prostata totale e nelle analisi stratificate per lo stadio (tutti P > 0.35) o grado della malattia (tutti P > 0.16).
In conclusione, l’adiposità generale, misurata come indice di massa corporea, risultava associata a un rischio ridotto di cancro alla prostata di basso grado rilevato con lo PSA. Tuttavia, gli effetti erano di piccole dimensioni e gli intervalli di confidenza avevano dei limiti molto vicini all’unità. Inoltre, l’obesità addominale, misurata con il WHR / circonferenza della vita, non si associava con il cancro alla prostata rilevato con lo PSA.
Chu DI della Duke University School of Medicine, Durham, USA e collaboratori, sulla base dell’aggiornamento delle linee guida di screening per il carcinoma della prostata (CaP) dell'American Cancer Society con cui l'esplorazione rettale (DRE) veniva resa opzionale, ne hanno studiato l'impatto negli uomini obesi (Prostate Cancer Prostatic Dis. 2011 Dec;14(4):346-53). Ottenuti, quindi, i dati di tre centri su 2.794 biopsie prostatiche iniziali, gli Autori hanno analizzato il rischio di CaP, attribuito alla DRE anomala, in rapporto alle varie categorie dell'indice di massa corporea (BMI). In tutte le coorti gli obesi avevano minori probabilità di un DRE diagnostico anomalo, rispetto ai normopeso. Con le categorie di BMI maggiori la DRE anomala diveniva sempre più forte predittivo di CaP complessivo individuale (P-trend ≤ 0,05) e nelle coorti combinate (P-trend <0,001). Lo era anche per l'alto grado di CaP nelle coorti italiane (P-trend = 0.03) e combinate (P-trend = 0.03). Comunque, l’inclusione della DRE migliorava l'accuratezza predittiva per il rilevamento massimale globale e del grado del CaP tra tutti gli obesi (P ≤ 0,032), ma non nei normopeso (P ≥ 0,198). Inoltre, l’inclusione della DRE migliorava anche il rilevamento globale del CaP vicino alla significatività negli obesi con PSA <4 ng ml (-1) (P = 0,081). In conclusione, il valore predittivo della DRE, secondo questo studio, sarebbe dipeso dall’obesità, essendo significativamente superiore tra gli obesi rispetto ai normopeso.
Hoda MR della Martin-Luther-Universität Halle/Wittenberg e collaboratori hanno voluto riesaminare e discutere il ruolo delle adipocitochine, quali ormoni derivati dagli adipociti, e le loro conseguenti implicazioni cliniche (Urologe A. 2012; 51(9):1253-60). Tutto ciò si basava sulle correnti conoscenze dell'impatto clinico e biologico dell'obesità sullo sviluppo e la progressione del cancro alla prostata. Gli Autori riscontravano, così, nella loro clinica che i pazienti con diagnosi di cancro alla prostata avevano una leptina sierica più alta e un’adiponectina in concentrazioni più bassa. Queste indagini e altri studi dimostravano, inoltre, che gli alti livelli sierici della leptina erano anche associati ai volumi maggiori del cancro della prostata, al suo alto grado di classificazione, alla sua recidiva biochimica, alle sue metastasi e alla loro progressione, ma anche all’aumento della mortalità. Inoltre, c'era una forte correlazione tra i livelli sierici di leptina e lo PSA sierico (prostate specific antigen). La leptina stimolava in vitro la proliferazione e inibiva l'apoptosi delle cellule tumorali in forma dose e tempo dipendente. Tuttavia, le linee cellulari resistenti all’androgeno rispondevano più fortemente.
Gli Autori commentavano, così, che a livello molecolare le adipocitochine richiedevano la rete della tirosin chinasi per realizzare gli effetti mitogenici e antiapoptotici nelle cellule tumorali. In effetti, gli elementi delle più importanti cascate di trasduzione del segnale, quali il MAPK (mitogen-activated protein kinases), il PI3-K (phosphoinositide 3-kinase) e lo JAK / STAT (Janus kinase/ Signal transducer and activator of transcription), erano attivati in seguito al legame della leptina al suo recettore sulla membrana cellulare delle cellule tumorali. Le adipocitochine, come la leptina, potevano, così, servire come nuovi parametri prognostici per la valutazione delle terapie specifiche per il carcinoma della prostata metastatico, refrattario alla terapia ormonale.
Nishimura K dell’Hyogo Prefectural Nishinomiya Hospital Nishinomiya, Japan e collaboratori, ritenendo poco chiaro il rapporto tra l’adiponectina e la leptina, ormoni polipeptidici degli adipociti, con il cancro della prostata, hanno svolto uno studio nei meriti (Minerva Urol Nefrol. 2012; 64(3):199-208). Hanno, così, arruolato cinquantaquattro pazienti, affetti da cancro della prostata, e settanta controlli, determinando i livelli di adiponectina e leptina nel siero, valutando poi le loro relazioni con il rischio di cancro prostatico dopo aggiustamento per età, fattori correlati all'obesità (peso e indice di massa corporea, circonferenza vita) e volume della ghiandola. La densità delle adipochine era calcolata dividendo i livelli sierici con il volume della prostata. Non si rilevavano differenze tra i valori medi di adiponectina e di leptina sieriche tra il cancro alla prostata e i gruppi di controllo benigni (P = 0,22 e 0,78, rispettivamente). I pazienti con livelli di entrambe le adipochine nel quartile più alto, dopo aggiustamento per l’età, avevano un rischio significativamente più alto del cancro alla prostata (adiponectina: odds ratio [OR] 2,79, P = 0,014; leptina: OR 2,72, P = 0,027). I pazienti con un livello di adiponectina superiore alla media, dopo aggiustamento per il peso corporeo, avevano anche un rischio significativamente elevato di cancro alla prostata (OR 2.22, P = 0.031), mentre quelli con un livello di leptina significativamente maggiore rispetto alla media avevano un rischio significativamente più basso (OR 0,46, P = 0,027). Inoltre, la densità di adiponectina mediana era significativamente più alta nel gruppo di cancro alla prostata, rispetto al gruppo con formazione benigna (P = 0.0033).
In conclusione, i livelli di adiponectina e di leptina nel siero erano indicatori utili per il rischio di cancro alla prostata, dopo gli aggiustamenti per l’età, l'obesità, i fattori connessi e il volume della prostata.
Obesità e cancro dell’endometrio
Nel 2008 in tutto il mondo 287.100 donne hanno ricevuto la diagnosi di cancro uterino. Questa neoplasia è la forma più comune ginecologica dei paesi sviluppati con un’incidenza del 12,9 per 100.000 donne e un tasso di mortalità di 2,4 per 100.000. Nei paesi in via di sviluppo è il secondo più comune tumore maligno ginecologico, secondo solo al cancro della cervice, con un'incidenza del 5,9 per 100.000 e un tasso di mortalità di 1,7 per 100.000.
I tassi d’incidenza di questo tipo di cancro sono riferiti, in effetti, fino a dieci volte superiori nei paesi industrializzati occidentali, rispetto all’Asia o all’Africa rurale e le variazioni nei tassi d’incidenza nel tempo, dopo lo sviluppo industriale, o la migrazione dalle aree dal basso verso l’alto rischio avrebbero dimostrato una sua relazione con i fattori ambientali, legati all’occidentalizzazione dello stile di vita, piuttosto che genetici. Il basso livello di attività fisica e l’obesità sono, in effetti, i fattori di rischi ambientali più probabili. In diversi studi, l'obesità è stata associata con l’aumento del rischio di cancro dell'endometrio di cinque volte, sia in fase pre e sia in post-menopausale e la sua incidenza nelle società opulente è stato stimata vicina al 40%. Considerando che in molti studi il rischio è stato dimostrato con aumento approssimativamente lineare proporzionalmente con il BMI (Body Mass Index), alcuni studi hanno anche dimostrato un effetto soglia per le donne obese con un BMI di circa 30 kg/m2 o superiore. Probabilmente, però, questo effetto soglia dovrebbe applicarsi, in particolare, al rischio del cancro endometriale giovanile in premenopausa. In età postmenopausale più avanzata varrebbe l'aumento più lineare. Tuttavia, i dati sono insufficienti per trarre una conclusione definitiva. È bene ricordare, peraltro, che oltre il peso corporeo in eccesso, l'evidenza epidemiologica suggerisce un possibile effetto protettivo della regolare attività fisica.
D’altro canto, anche se i meccanismi non sono completamente chiari, gli ormoni endogeni devono giocare un ruolo importante nello sviluppo del cancro endometriale. In effetti, il suo aumento è stato associato con il menarca precoce e con la menopausa tardiva, suggerendo in premenopausa un rapporto di rischio con una maggiore esposizione ai livelli degli estrogeni. Altri fattori ormonali associati al rischio sono la parità e l'uso di estrogeni esogeni per la contraccezione orale o della terapia sostitutiva in menopausa. Inoltre, il rischio è stato correlato, oltre che alle concentrazioni plasmatiche degli estrogeni, anche a quelli del progesterone, degli androgeni, dello SHBG (Sex Hormone Binding Globulin) e dell’insulina. Si ritiene generalmente che anche l'eccesso del peso influenzi il rischio del cancro endometriale attraverso cambiamenti nel metabolismo ormonale endogeno.
Dal punto di vista istologico e di patologia molecolare i tumori endometriali si possono distinguere in:
- Tipo I, per lo più carcinomi endometrioidi, in misura fino all’80% circa dei totali, che si associano generalmente con l’iperplasia endometriale.
- Tipo II, più spesso carcinomi papillari sierosi, a cellule chiare, o squamosi, che generalmente si sviluppano in donne più anziane dal tessuto endometriale atrofico.
I carcinomi di Tipo I si associano a mutazioni nel RAS proto - oncogene e nel gene PTEN soppressore del tumore. Spesso mostrano instabilità dei microsatelliti, ma di solito non delle mutazioni nel gene p53, soppressore del tumore. Al contrario, la maggior parte dei tumori di Tipo II ha mutazioni del p53, ma quasi mai dell'instabilità del microsatellite o del RAS o mutazioni del PTEN. Sebbene la maggior parte degli studi epidemiologici non abbia fatto distinzione tra questi due tipi di tumore e quegli studi che hanno preso in considerazione il Tipo II siano solitamente di piccole dimensioni, vi è qualche evidenza che il sistema endocrino e lo stile di vita nutrizionale e l’obesità influenzino il rischio del Tipo I, ma non del Tipo II.
Pur tuttavia, è ormai acclarato che gli eccessi di esposizione agli estrogeni, non bilanciati dai progestinici, stimolando la proliferazione delle cellule uterine, costituiscano il fattore di rischio per il cancro. In effetti, a causa dell’influenza ormonale, il tessuto endometriale cambia notevolmente durante il ciclo mestruale. Difatti, durante il ciclo gli estrogeni stimolano la crescita dell'endometrio su cui agisce il progesterone dopo l'ovulazione, in preparazione di un’eventuale gravidanza. Se si verifica questo evento, l'endometrio continua a svilupparsi, in caso contrario i livelli di progesterone scendono e il rivestimento uterino viene eliminato con la mestruazione. Quando l'endometrio è esposto agli estrogeni non bilanciati, come nel caso del loro uso farmacologico o di un ciclo anovulatorio, aumentano i rischi dell’ispessimento iperplastico endometriale e, quindi, del cancro endometriale.

È quanto si può verificare, come accennato, nelle donne in postmenopausa per gli elevati livelli circolanti di estrogeni, ma anche di androgeni, oppure per effetto dell’insulina o dei suoi fattori di crescita che tendono ad aumentare l’azione ormonale, specifica sul tessuto dell'utero.
Per suo conto, quindi, l'epidemia dell’obesità si propone ormai come un fattore primario epidemiologico del preoccupante aumento d'incidenza del cancro endometriale, soprattutto nei paesi economicamente sviluppati. Peraltro, essa è spesso associata all'ipertensione e all'età avanzata, come importante fattore di rischio in rapporto al continuo aumento dell'aspettativa di vita, soprattutto per le donne. Contribuisce, peraltro, a limitare la mobilità delle pazienti con il rischio di cadute e di usura delle articolazioni. Si associa anche al diabete che favorisce complessivamente l’aumento d'incidenza di cancro endometriale. Di fatto, va notato che le donne con carcinoma endometriale tendono a morire più comunemente per le comorbidità mediche, piuttosto che per la malattia neoplastica. In ogni caso, peraltro, le malattie cardiache sono quelle più comunemente chiamate in causa.
Rudolf Kaaks dell’Umeå University Hospital, Sweden e collaboratori, nell’intento di proporre un modello endocrino per l'eziologia dei tumori endometriali di Tipo I, hanno voluto rivisitare le conoscenze dei rapporti tra l’eccesso di peso, gli ormoni sessuali endogeni e il rischio di cancro dell'endometrio (Cancer Epidemiol Biomarkers Prev December 2002 11; 1531). Gli Autori hanno passato in rassegna le principali ipotesi e osservazioni riguardanti i rapporti di rischio tra il tumore dell'endometrio con gli steroidi endogeni sessuali, lo SHBG e l'insulina. Hanno, quindi, discusso le conseguenze metaboliche comuni e ormonali dell’eccesso di peso e, infine, hanno tentato un’integrazione delle diverse teorie e risultati della letteratura.
Le alterazioni nel metabolismo degli ormoni endogeni potevano fornire i principali collegamenti tra il rischio di cancro dell'endometrio, il peso corporeo in eccesso e l'inattività fisica. Gli studi epidemiologici avevano già dimostrato un aumentato rischio del carcinoma endometriale tra le donne in pre e post-menopausa, che avevano un androstenedione e testosterone plasmatici elevati. Lo stesso si riscontrava nelle donne in post-menopausa con aumentati livelli di estrone ed estradiolo. Inoltre, vi erano evidenze che l'iperinsulinemia cronica era un fattore di rischio.
Queste relazioni potevano essere interpretate alla luce dell'ipotesi degli effetti mitogeni degli estrogeni, quando questi non erano sufficientemente controbilanciati dal progesterone.
Gli Autori nella loro sintesi complessiva concludevano che per il rischio di cancro endometriale lo sviluppo dell’iperandrogenismo ovarico poteva rappresentare un meccanismo centrale relativo ai fattori di stile di vita nutrizionale. Nelle donne in premenopausa l’iperandrogenismo ovarico probabilmente aumentava il rischio inducendo l’anovulazione cronica e la carenza del progesterone. Dopo la menopausa, quando la sintesi del progesterone cessava del tutto, l'eccesso del peso, attraverso gli elevati livelli plasmatici dei precursori degli androgeni trasformati per aromatizzazione nel tessuto adiposo in estrogeni, poteva continuare ad aumentare il rischio. L'eccesso degli androgeni ovarici poteva, pertanto, costituire la causa di un’interazione tra obesità, iperinsulinemia cronica con i fattori genetici predisponenti allo sviluppo dell’iperandrogenismo ovarico.
Pike MC dell’USC/Norris Cancer Center, Los Angeles, USA e collaboratori hanno discusso il forte rallentamento epidemiologico del tasso di crescita dei tumori della mammella, dell’endometrio e dell’ovaio con l'età nel periodo della menopausa (Oncogene. 2004 Aug 23;23(38):6379-91). L'incidenza di questi tumori dall'età di settanta anni sarebbe dalle quattro alle otto volte maggiore se il rapido aumento che si registra con l'età nelle giovani donne continuasse fino alla tarda età. Questi fenomeni possono spiegarsi con i diversi effetti degli ormoni ovarici sui tassi di divisione cellulare nei tessuti interessati. Modelli di questi effetti fornirebbero, difatti, una spiegazione plausibile della maggior parte dell’epidemiologia nota di ciascuno dei cancri, compreso l'aumento del rischio del cancro al seno in corso di terapia estro-progestinica in menopausa. Alcuni risultati epidemiologici sul cancro dell’endometrio e ovarico suggeriscono, peraltro, innovativi percorsi per la possibile chemioprevenzione in questi tumori.
L’eccesso di peso, per suo conto, in post-menopausa aumenta i livelli di estrogeni e in premenopausa può disturbare l'ovulazione e la produzione di progesterone con la conseguente esposizione continua dell’utero agli estrogeni senza il bilanciamento del progesterone. In ogni caso, le donne con i più alti livelli di globulina legante gli ormoni sessuali, modulando la biodisponibilità degli estrogeni e degli androgeni, dimostrano una significativa riduzione del rischio. Comunque, l'aumento del rischio del cancro endometriale nelle donne obese deriva anche dagli effetti infiammatori del tessuto adiposo. Difatti, gli adipociti esprimono l'aromatasi che converte gli androgeni ovarici in estrogeni, inducendo la crescita dell'endometrio. Peraltro, la globulina legante gli ormoni sessuali ha livelli più bassi nelle donne obese, per cui la quota di ormone biologicamente attivo risulta maggiore. Inoltre, si aggiunge l'azione dell'insulina, spesso alterata in tale contesto per un livello di globuline leganti ridotto e, quindi, d’insulina libera elevata. L’insulina e l’IGF (insulin-like growth factors) sono in grado anche di esercitare un effetto proliferativo sull'endometrio, insieme con altri fattori di crescita, come quello epidermico. L’insulina e l’IGF vengono, quindi, a stimolare la proliferazione endometriale attraverso percorsi che sono già iperattivi nelle donne a rischio di cancro dell'endometrio. Inoltre, il tessuto adiposo secerne adipochine ad azione pro flogistica, in parte responsabili dell'insulino-resistenza che accompagna l'obesità e che svolge, così, un ruolo nell’aumento della proliferazione endometriale. L'adiponectina, anch’essa prodotta dal tessuto adiposo, riveste, invece, un effetto inibitorio sulle vie di proliferazione. Il suo livello è inversamente correlato con la massa grassa.
In conclusione, numerosi percorsi, che comprendono quelli della conversione dagli androgeni agli estrogeni per via dell’aromatasi, dell’elevato livello di estrogeni liberi, dell’insulina e dell’IGF, dell’aumento della secrezione di adipochine infiammatorie, del basso livello di adiponectina, possono spiegare l'aumento del rischio di tumore dell'endometrio nelle donne obese.
Capire i meccanismi e l'importanza di queste vie conduce, di certo, alle opzioni più efficaci del trattamento. Ad esempio, è già noto che il progesterone nella combinazione con l’estrogeno in pillole anticoncezionali o in terapia orale o intrauterina può essere utilizzato sia per proteggere e trattare l'iperplasia endometriale sia per combattere il cancro. Peraltro, la perdita di peso con quella consequenziale del tessuto adiposo si associa con una riduzione del rischio. In effetti, la perdita di peso con la dieta, con l'esercizio fisico, o con la chirurgia bariatrica comporta questo effetto protettivo. Inoltre, anche l'uso dei farmaci antidiabetici, quali la metformina, può ridurre il rischio, ottenendosi una riduzione dei livelli d’insulina e il calo di peso corporeo e, quindi, l’attivazione di quei percorsi che inibiscono la proliferazione cellulare. La metformina, peraltro, ha anche dimostrato di ridurre l'attività dell'aromatasi degli adipociti e di aumentare l'espressione del recettore del progesterone.
Dossus L del German Cancer Research Center, Heidelberg, Germany e collaboratori hanno voluto chiarire nello studio prospettico europeo EPIC (European Prospective Investigation into Cancer and Nutrition) l’associazione tra il rischio del cancro endometriale con i fattori riproduttivi, come l’età del menarca, della menopausa, della parità, del primo e dell'ultimo parto, del tempo dall'ultima nascita, e l'uso di contraccettivi orali (CO). Gli Autori identificavano, così, 1.017 casi di cancro endometriale tra le 302.618 donne eleggibili per lo studio. Si osservava una riduzione del rischio nelle donne con menarca tardivo, menopausa precoce, passato uso di OC, alta parità e un tempo più breve dall'ultima gravidanza a termine (FTP). Nessuna associazione si osservava per la durata dell’allattamento dopo aggiustamento per il numero della FTP o per aborti spontanei o indotti. Dopo aggiustamento reciproco, la tarda età del menarca, quella della menopausa e la durata dell'uso di OC mostravano una riduzione del rischio simili pari al 7-8% per ogni anno di vita mestruale, considerando che la diminuzione del rischio associato alla durata cumulativa del FTP era più forte e pari al 22% per anno.
In conclusione, secondo gli studiosi, i risultati dello studio confermavano una riduzione del rischio del tumore dell'endometrio con i fattori associati a una minore esposizione cumulativa agli estrogeni e / o una maggiore esposizione al progesterone, come all’aumento del numero dei FTP mestruali e alla più breve durata. Tutto ciò, quindi, era a supporto di un importante ruolo dei meccanismi ormonali nella carcinogenesi endometriale (Int J Cancer. 2010 Jul 15;127(2):442-51).
Soliman PT dell’University of Texas, Houston, USA, per valutare se le donne nella popolazione generale fossero a conoscenza della relazione tra obesità e rischio di cancro e per individuare i gruppi che potessero beneficiare dei programmi educativi, hanno condotto un autosondaggio sulle donne della comunità di Houston (Obstet Gynecol. 2008; 112(4):835-42). Completavano la prova 1.545 donne, di cui il 28% era con peso normale e con indice di massa corporea [BMI] inferiore ai 25 kg / m2, il 24% in sovrappeso (BMI 25-30 kg / m2) e il 45% con obesità (BMI di almeno 30 kg / m2). Il 58% (intervallo di confidenza 95%: 56-61%) non era a conoscenza che l'obesità potesse aumentare il rischio del tumore dell'endometrio. Peraltro, non si rilevava differenza nella conoscenza del rischio del cancro endometriale associato con una qualsiasi delle caratteristiche demografiche studiate. Le donne di colore risultavano le più propense a rispondere che non erano affatto a conoscenza della relazione. Non c'era, d’altra parte, nessuna associazione tra il peso e la conoscenza personale dell’obesità associata al rischio.
In conclusione, lo studio rilevava che c'era una scarsa conoscenza della relazione tra l’obesità e il rischio di cancro, in particolare tra le donne di colore. L'educazione delle pazienti, per quanto riguardava questi rischi, poteva, peraltro, aumentare la consapevolezza nei meriti.
Dossus L del DKFZ (Deutsches Krebsforschungszentrum) e collaboratori, considerando l’obesità uno dei maggiori fattori di rischio per il cancro endometriale, perché consistente in un basso grado di stato infiammatorio con elevate concentrazioni di citochine e proteine della fase acuta, hanno voluto indagare:
- Le associazioni della CRP (C-reactive protein), dell’IL-6 (interleukin 6) e dell’IL1Ra IL1 (IL1 receptor antagonist) con il rischio di cancro endometriale.
- In che misura tali marcatori potessero influenzare l’associazione tra l’obesità e il cancro dell'endometrio.
Gli Autori hanno, così, condotto uno studio caso-controllo nell’ambito dell’European Prospective Investigation into Cancer and Nutrition (Endocr Relat Cancer. 2010; 17(4):1007-19). Hanno, quindi analizzato 305 casi di carcinoma dell'endometrio e 574 controlli appaiati. La CRP, l’IL6 e l’IL1Ra erano misurate con il metodo immunologico in campioni di sangue raccolti in maniera prospettica. I dati erano analizzati usando la regressione logistica condizionale. Tutti i test statistici erano a due bracci e i valori del p <0,05 erano considerati statisticamente significativi.
Gli Autori osservavano un aumento significativo del rischio di tumore dell'endometrio con i livelli elevati della CRP (odds ratio (OR) per il quartile più alto rispetto al più basso: 1,58, intervallo di confidenza 95% (IC): 1,03-2,41, P = 0,02), dell’IL6 (OR del più alto vs il più basso: 1,66, IC 95%: 1,08-2,54, P = 0.008) e dell’IL1Ra (OR del più alto vs il più basso quartile: 1.82, 95% IC: 1,22-2,73, P = 0,004). Dopo aggiustamento per l’indice di massa corporea (BMI), le stime erano fortemente ridotte sino a divenire non significative. Inoltre, l'associazione tra la BMI e il cancro endometriale era notevolmente attenuata (~ 10-20%) dopo aggiustamento per i marcatori infiammatori, anche quando gli effetti del C-peptide o dell’estrone erano già stati presi in considerazione. Gli Autori affermavano, così, di aver fornito l'evidenza epidemiologica che l'infiammazione cronica poteva mediare l'associazione tra l’obesità e il cancro endometriale e che una condizione infiammatoria avrebbe potuto promuovere la carcinogenesi endometriale.
Chen X della Vanderbilt University Medical Center, Nashville, Tennessee USA e collaboratori, considerando nell'obesità l’associazione tra i livelli circolanti di adiponectina e di leptina con il rischio del cancro dell'endometrio, riconoscendo scarse le conoscenze sulle possibili correlazioni con il cancro endometriale da parte degli SNP (single nucleotide polymorphisms) dei geni che codificano l'adiponectina (ADIPOQ), la leptina (LEP), il recettore dell’adiponectina 1 (AdipoR1), quello dell’adiponectina 2 (AdipoR2) e il recettore della leptina (LEPR), hanno selezionato ottantasette codifiche di SNP per catturare le varianti genetiche comuni in questi cinque geni (Cancer. 2012; 118(13):3356-64). Gli Autori hanno, quindi, valutato questi SNP in 1.028 casi di cancro dell'endometrio e in 1.932 controlli comunitari rilevati dalle donne cinesi, utilizzando modelli di regressione logistica per stimare gli odds ratio (OR) e gli intervalli di confidenza al 95% (IC 95%). Tre dei dieci SNP valutati nel gene ADIPOQ erano significativamente associati alla riduzione del rischio del cancro. L'OR per gli omozigoti per l'allele minore (A / A) per il rs3774262 era pari a 0,68 (IC 95%, 0,48-0,97), rispetto alle donne omozigoti per l'allele maggiore (G / G). Risultati simili si riscontravano per lo SNP rs1063539 e rs12629945 nell’ADIPOQ, che erano in legame di squilibrio con il rs3774262. Queste associazioni divenivano non significative dopo l’applicazione della correzione di Bonferroni. I controlli con l'allele minore A del rs3774262 avevano un peso minore, una circonferenza vita e fianchi più piccoli e un indice di massa corporea inferiore, rispetto ai controlli con l'allele G maggiore (P <.05). Gli omozigoti per l'allele minore (T / T) del rs2071045 nel gene LEP avevano anche un rischio significativamente più basso (OR, 0,70, 95% IC, 0,54-0,90), rispetto alle donne omozigoti per l'allele maggiore (C / C). Nessun altro SNP nel LEP, AdipoR1, AdipoR2, o nei geni LEPR risultava associato al rischio di cancro.
In conclusione, secondo gli Autori anche senza poter escludere altre possibilità, i loro risultati suggerivano che i polimorfismi genetici del gene ADIPOQ potevano giocare un ruolo importante nello sviluppo del cancro dell'endometrio.
Cher M Dalla del National Cancer Institute, National Institutes of Health, Bethesda, Maryland e collaboratori, sempre considerando poco chiari i meccanismi con cui l’obesità tende a influenzare il rischio del cancro endometriale, hanno condotto uno studio caso-controllo all'interno della Breast and Bone Follow- up del Fracture Intervention Trial su 15.595 soggetti, valutando in pre- diagnosi la leptina sierica, l’adiponectina totale e quella HMW (high-molecular-weight) in relazione al cancro endometriale nelle donne in postmenopausa (Endocr Relat Cancer February 1, 2013 20 151-160). In effetti, la leptina e l’adiponectina, secrete dal tessuto adiposo, avevano già dimostrato di giocare un ruolo in tali processi cancerogeni, come la proliferazione cellulare, l'angiogenesi e la regolazione dell'insulina. Durante i dieci anni di follow- up, si rilevavano sessantadue casi di cancro endometriale ed erano abbinati a 124 controlli per età, posizione geografica, tempo di digiuno del prelievo di sangue al basale nel 1992-1993 e lo stato di partecipazione alla sperimentazione. Le adipochine e il peptide - C erano misurati mediante ELISA. Gli Odds ratio (OR) e gli intervalli di confidenza al 95% (IC 95%) erano stimati tramite regressione logistica condizionale con esposizioni classificate in terzili (T). Erano considerati modelli multivariati per il peptide - C, il BMI (kg/m2) e l’estradiolo (E2), come confondenti potenziali. Il rischio di cancro endometriale era significativamente associato con i livelli di leptina più elevati, con rettifica per l’E2 e il peptide - C (ORT3 vs T1 = 2.96, IC 95 %: 1,21-7,25 , P < 0.01 ). Dopo ulteriore aggiustamento per il BMI le stime erano attenuate e il trend positivo non era più statisticamente significativo (RT3 vs T1 = 2,11, IC 95%: 0,69-6,44, p trend = 0.18 ). Non si osservava nessuna associazione significativa dell’adiponectina o della HMW con il cancro dell'endometrio.
Secondo gli Autori, i risultati dello studio suggerivano che la leptina con l'asse leptina - BMI avrebbe potuto aumentare il rischio del cancro endometriale attraverso meccanismi diversi dall’influenza proliferativa degli estrogeni.












.png)





