NOTIZIARIO Marzo 2013 N°3
MICROBIOTA INTESTINALE E SALUTE
A cura di:
Giuseppe Di Lascio §
Con la collaborazione di:
L’intestino e le sue difese dai potenziali agenti patogeni
L'epitelio della mucosa del tratto gastrointestinale è continuamente sottoposto all’attacco dei potenziali agenti patogeni. Le difese dell’organismo si concretano in forme chimiche, come gli enzimi salivari e l’acidità gastrica, e nella produzione di una potente barriera superficiale della mucosa. Tuttavia, è anche necessaria una risposta immunitaria di difesa completa adattativa, soprattutto contro gli organismi microbici più virulenti. Il GALT (gut associated lymphoid tissue) comprende le placche del Peyer, i linfonodi mesenterici, le cellule interdigitate, le plasmacellule e i linfociti presenti nella lamina propria. Il ruolo del GALT è di gestire la risposta immunitaria all’esposizione antigenica massiccia dei patogeni, sperimentata dall'intestino. Tale condizione rappresenta, invero, una forma di evoluzione dell'intestino per la protezione contro gli organismi patogeni derivati dagli alimenti. Il tratto gastrointestinale è, in effetti, un ecosistema complesso che associa un microbiota residente e diversi fenotipi di cellule superficiali di rivestimento con attività metaboliche complesse. Bisogna, in effetti, considerare il tratto gastrointestinale umano come un organo di grande superficie costituito essenzialmente da tre componenti maggiori in continuo contatto e interazione tra loro:
- le cellule dell’ospite,
- i batteri,
- i nutrienti.
Le cellule epiteliali nel giro di 2-3 giorni dalla loro generazione nelle cripte dei villi migrano verso l’apice e vanno incontro all’esfoliazione. Durante tale processo alcune possono differenziarsi in cellule globose, che producono la mucina della barriera del muco, o in cellule M, altamente specializzate. Le cellule del Paneth, invece, migrano verso il fondo della cripta e producono, per un’ulteriore difesa contro i microrganismi, il lisozima, la defensina e la fosfolipasi A2. Le placche del Peyer costituiscono il sistema immunitario con le aree dei linfociti B e T coperte dalle cellule M che comunicano con il tessuto linfoide e contribuiscono al controllo della difesa immunitaria. L’intestino umano, inoltre, ospita dalle 500 alle 1000 specie diverse di batteri e oltre 1200 ceppi virali. Le prime, nell’ordine di 1014 UFC / ml (colony-forming units), cioè centomila miliardi pari a dieci volte le cellule dell’intero corpo umano, possono raggrupparsi in due grandi ordini:
- i batteri autoctoni sin dalla nascita che dopo lo svezzamento diventano colonie stabili permanenti con caratteristiche così particolari di alcuni ceppi tali da costituire per qualità e quantità un imprintig costante d’identificazione più preciso delle impronte digitali,
- i batteri alloctoni transitori, introdotti con il cibo, come formaggi, salumi e alimenti fermentati, che in caso di aumento eccessivo causano squilibri anche gravi dalla disbiosi alle malattie.
A parte va considerata la candida albicans, presente nella normale flora batterica della bocca, dell'intestino e della vagina, anche colonizzatore frequente della pelle umana e delle mucose. Purtroppo, essa è in tutto il mondo la forma fungina patogena più comune ed è una delle principali cause d’infezioni nosocomiali gravi e spesso mortali, soprattutto in caso di paziente immunocompromesso. I probiotici, come il Lactobacillus spp. nella candidosi vaginale, sono stati ampiamente studiati e utilizzati. Studi sull’epitelio umano ricostituito e sulle colture cellulari mono strato hanno dimostrato che L. rhamnosus GG può proteggere la mucosa dai danni causati dalla candida albicans e migliorare le risposte immunitarie delle superfici mucosali. Questi risultati offrono, pertanto, la promessa sull'uso dei probiotici come nuove opzioni per la terapia antifungina.
In ogni caso, la flora batterica intestinale svolge un ruolo importante nella fisiologia intestinale, contribuendo al mantenimento della salute dell'ospite. Quest’ultimo è, così, protetto dagli attacchi dei microrganismi potenzialmente dannosi dalle barriere fisiche e chimiche create dall’epitelio gastrointestinale.
Le cellule che rivestono l'epitelio gastrointestinale e del microbiota residente sono due partner rivolti a funzionare correttamente e / o sinergicamente per promuovere un efficiente sistema di difesa dell’ospite.
Le cellule gastrointestinali che compongono l'epitelio, forniscono, di fatto, una barriera fisica di protezione contro l'invasione dei microrganismi. L'epitelio intestinale, il sistema immunitario mucosale e la flora batterica rappresentano, pertanto, un apparato morfofunzionale in equilibrio dinamico. Questo complesso è in grado di regolare l'assunzione dell'energia dall'intestino, di digerire i polisaccaridi comuni della dieta altrimenti indigeribili, di produrre o attivare le molecole di segnale coinvolte nel metabolismo dell'ospite, di modificare la permeabilità intestinale, di rilasciare ormoni intestinali, ma anche di promuovere l'infiammazione.
Diverse evidenze indicano ormai che le diete più ricche di fibra sono in grado di modificare il microbiota e di accelerare il transito intestinale. Accelerare il transito con la senna ha dimostrato di aumentare la produzione degli acidi grassi a catena corta (SCFA), ma anche di ridurre nello stesso tempo i batteri metanogenici fecali, con effetto opposto, quindi, alla loperamide. L’accelerazione con cisapride aumenta anche la produzione di SCFA, in particolare dell’acido propionico e butirrico. L’acetato, prevalente nei contenuti del colon, ha, invece, azione largamente inibitrice. In contrasto, il propionato e il butirrato stimolano la motilità intestinale, attivano nell’uomo schemi motori propulsivi ileali e garantiscono che i batteri siano spinti dall’ileo nel colon. Il microbiota normale ha anche la proprietà d’influenzare fortemente il sistema immunitario della mucosa. Tale capacità è poco sviluppata negli animali privi di germi i quali hanno un ridotto numero delle cellule T, di quelle B che producono immunoglobuline A e di cellule T intraepiteliali. Studi sui gemelli hanno indicato che il genotipo dell’ospite influenza il microbiota dell'intestino, anche se i risultati rimangono contrastanti a causa dell’incapacità di controllare i fattori ambientali condivisi. Uno degli effetti genetici più importanti è mediato dalla risposta immunitaria innata. Così che, i topi privi del recettore sensibile al dominio batterico legante il nucleotide di oligomerizzazione, contenente la proteina-2, hanno mostrato un numero significativamente maggiore di Bacteroidetes e anche di Firmicutes rispetto ai topi di tipo selvatico.

D’altra parte, un certo numero di meccanismi di accoglienza dell’ospite partecipa a modulare la presenza del microbiota intestinale. Si possono distinguere, così, fattori intrinseci ed estrinseci con una funzione di blocco e che possono alterare la flora batterica. Gli antibiotici, ad esempio, secondo lo spettro e del dosaggio, possono interessare direttamente la composizione del microbiota. Anche le modificazioni della dieta, soprattutto in presenza di probiotici e fibre, possono contribuire in tal senso. I MMC (migrating motor complexes), gli ioni d’idrogeno, la tensione parziale d’ossigeno, le sIgA (secretory immunoglobulin A), i PPI (proton pump inhibitor) e i FANS (non-steroidal anti-inflammatory drug), possono tutti contribuire ai meccanismi di accoglienza e partecipare alla modulazione del microbiota intestinale.
La terminologia essenziale nello studio del microbiota
I microbi che esistono nel corpo dell’uomo sono, quindi, noti collettivamente come il microbiota, che, incredibilmente complesso e mal compreso, ha un enorme impatto sull’esistenza dell’ospite. Ognuna delle comunità microbiche ha una sua struttura e un rapporto con gli ecosistemi, secondo l’ambiente del corpo, dove si trovi. L'obiettivo fondamentale della ricerca sul microbioma umano è quello di misurarne la sua struttura e la sua dinamica con i rapporti tra i loro membri, determinandone, ove possibile, le sostanze prodotte e consumate, l'interazione con l'ospite e le differenze tra sani e malati.

Il microbiota intestinale dai primi anni di vita alla tarda età
Una delle funzioni fisiologiche di base del microbiota residente è quella di barriera, con meccanismi ancora non ben definiti, contro i microbi patogeni. Nell’adulto la microflora intestinale è costituita da una prevalenza di batteri asporigeni, anaerobi obbligati, principalmente batteriodi e fusobatteri Gram negativi. I bifido batteri, invece, sono i più comuni tra i Gram positivi.
Il microbiota, già durante le prime fasi della vita neonatale e forse anche in utero, influenza entrambe le funzioni metaboliche e quelle del sistema immunitario dell’ospite. La trasmissione dei batteri dalla madre al neonato, attraverso il contatto diretto con la flora batterica materna durante il parto e attraverso il latte durante l'allattamento, influenzerebbe la colonizzazione dell'intestino del neonato con conseguenze potenziali sulla salute.
Alla nascita il bambino umano, in effetti, è condotto a sviluppare, da un ambiente sterile, un ecosistema microbico ricco e dinamico. Durante il primo anno di vita e fino allo svezzamento l'ecosistema intestinale è prevalentemente colonizzato da microrganismi opportunisti, cui il bambino è esposto nel suo ambiente. I primi germi sono spesso aerobi, come lo Streptococcus aureus e gli Enterobatteri, seguiti dagli anaerobi, come gli eubatteri e i clostridi. Il neonato allattato al seno, di poi, sperimenta in genere la colonizzazione intestinale in gran parte dominata dal Bifidobacterium. Dopo lo svezzamento insieme all'introduzione di una dieta solida e alle modificazioni di sviluppo della mucosa intestinale, si realizza, con le caratteristiche di una notevole biodiversità microbica, la transizione della flora intestinale verso il profilo dell’adulto. L'invecchiamento della flora intestinale inizia dopo una determinata età dipendente dalle caratteristiche individuali relative alla dieta, alla razza ed etnia e, infine, alla fragilità. In ogni caso, i cambiamenti della dieta, dello stile di vita e del decadimento immunologico della senescenza determinano il drastico impatto sull'ecologia microbica del tratto gastrointestinale. Simmetricamente a quanto avviene nella fase iniziale della nostra vita, il tipo del microbiota della persona anziana mostra una bassa biodiversità microbica ed è caratterizzato da un aumento opportunistico ambientale dei microbi facoltativi aerobi della specie Staphylococcus, Streptococcus, Enterobacteriaceae. D’altra parte, diminuiscono gli anaerobi, come il Clostridium cluster IV e XIV bis e i Bacteroidetes. Tuttavia, il tipo di microbiota dell’anziano, diversamente da quello del bambino, è caratterizzato da una bassa presenza di Bifidobacterium.
Per quanto riportato, come una possibile strategia dietetica per ridurre il rischio delle malattie, è stata proposta la modulazione intenzionale della composizione del microbiota attraverso l'uso di probiotici durante il periodo perinatale e postnatale.
In effetti, un profilo di sana flora batterica intestinale nei primi anni della vita viene sempre più legato alla salute dell’adulto. Una composizione aberrante, invece, si assocerebbe a un rischio di problemi sistemici, come l'obesità, il diabete e le malattie allergiche, tra cui l'asma e le patologie infiammatorie intestinali. In particolare, ciò è valido soprattutto per quanto riguarda i bifidobatteri e si collega direttamente alla modalità del parto naturale e alla qualità del latte materno, a sua volta influenzato dalla salute sistemica e dallo stato nutrizionale materni. Le donne in gravidanza di peso corporeo normale e con profili di microbiota sano, sia come flora intestinale sia del latte, hanno maggiori possibilità di passare composti, antigeni e altri agenti in grado di promuovere lo sviluppo di un sano sistema immunitario del neonato allattato al seno. Più recentemente lo sviluppo del microarray filogenetico ha permesso una molto più rapida analisi dei filotipi rappresentati durante tutta la vita nel normale e nell’abbondante microbiota. Gli studi sui gemelli monozigoti hanno, invero, dimostrano di conservarlo in modo molto simile per decenni dopo la nascita. La colonizzazione e la diversità del microbioma sono, quindi, fortemente indicative dell’influenza specifica dell’ospite. In effetti, la sua diversità nel corpo umano mostra, al contempo, ricchezza e anche uniformità. La diversità aumenta rapidamente dalla nascita, raggiungendo il suo massimo nella prima età adulta, prima della tarda. Confrontando gli estremi di età, si possono dimostrare marcate differenze nella composizione del microbioma per minore rappresentazione delle specie produttrici di butirrato e per una maggiore presenza di potenziali patogeni nei centenari.
Interessante, a tale proposito, è la recente definizione degli esseri umani come metaorganismi, proprio a seguito della stretta relazione simbiotica con il microbiota intestinale. Quest’assunto impone, invero, una visione più olistica del processo dell’invecchiamento in cui le dinamiche d’interazione tra ambiente, microbiota intestinale e ospite devono essere prese in considerazione tutte insieme. I cambiamenti fisiologici del tratto gastrointestinale legati all'età, così come quelli dello stile di vita, del comportamento nutrizionale e della funzionalità del sistema immunitario, influenzano inevitabilmente l'ecosistema del microbiota. In effetti, la crescente evidenza dell'importanza dell’omeostasi del microbiota intestinale per la salute dell'ospite ha portato alla ribalta le applicazioni mediche / nutrizionali di queste conoscenze, attraverso lo sviluppo di preparati probiotici e prebiotici specifici per la popolazione anziana.
R Luoto della Turku University Hospital – Finland e collaboratori, proprio sulla base degli inadeguati risultati nella lotta contro l’epidemia mondiale dell’obesità e del ruolo strumentale del microbiota intestinale nel metabolismo ospite, hanno voluto valutare nel corso di dieci anni di follow-up l'impatto di un intervento perinatale con i probiotici sui modelli di crescita dei bambini e sullo sviluppo del sovrappeso (International Journal of Obesity (2010) 34, 1531–1537). Gli Autori hanno, così, randomizzato 159 donne in doppio cieco a ricevere probiotici in dose di 1 × 1010 unità formanti colonia di Lactobacillus rhamnosus GG, ATCC 53103, o placebo per quattro settimane, prima del parto previsto. L'intervento si estendeva anche per sei mesi dopo la nascita. Le misure antropometriche di 113 bambini, corrispondenti al 72% dei totali, erano rilevate all'età di tre, sei, dodici e ventiquattro mesi e a quattro, sette e dieci anni. L'eccessivo aumento di peso era rilevato in una fase iniziale durante il periodo fetale e di seguito fino ai 24-48 mesi di età e in una seconda fase dopo 24-48 mesi.
L'intervento perinatale con probiotico sembrava moderare la fase iniziale di eccessivo aumento di peso, soprattutto nei bambini che in seguito arrivavano al sovrappeso, ma non la seconda fase, essendo più pronunciate le conseguenze all'età dei quattro anni (P = 0,063, analisi della varianza per misure ripetute). L'effetto dell’intervento si dimostrava anche come tendenza a ridurre l’indice di massa medio corporeo all'età dei quattro anni, aggiustato per il peso alla nascita (P = 0,080, all’analisi di covarianza).
In conclusione, secondo gli Autori, la precoce modulazione della flora intestinale con probiotici sarebbe stata in grado di modificare il modello di crescita dei bambini, frenando l’eccessivo aumento del peso durante i primi anni di vita.
Mirjana Rajilić-Stojanović della Wageningen University - the Netherlands e collaboratori dall’analisi di tre campioni fecali raccolti consecutivamente da dieci persone, cinque adulti e cinque giovani anziani, hanno ottenuto le dinamiche temporali confermando che il microbiota intestinale adulto era un ecosistema individuale specifico e relativamente stabile (Environ Microbiol. 2009 July; 11(7): 1736–1751).
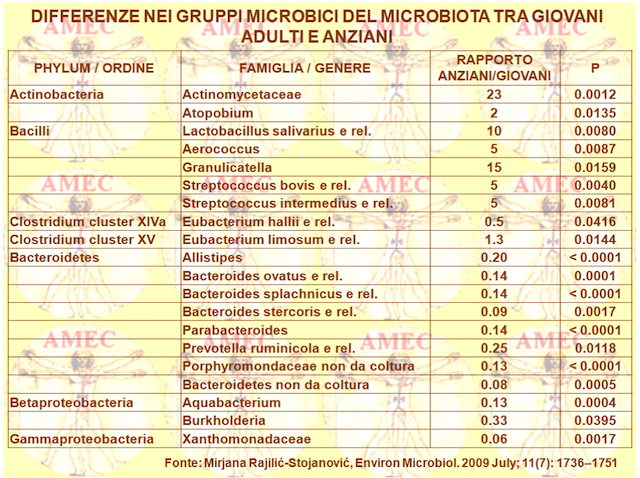
Ulteriori analisi della parte stabile consentivano l'identificazione di un nucleo di microbiota universale, a livello di genere approssimativo, con similarità di sequenza del 90%. Questo nucleo era composto di ceppi degli Actinobacteria, dei Bacteroidetes e dei Firmicutes. Utilizzato come strumento filogenetico al pari delle impronte digitali con la possibilità di quantificazione relativa, l’HITChip (human intestinal tract chip) aveva, quindi, il potenziale di colmare le lacune della nostra conoscenza sulla descrizione quantitativa e qualitativa della composizione del microbiota gastrointestinale umano.
L’HITChip rivelava, quindi, la possibilità di una quantificazione relativa con comparazione simultanea delle quantità di oltre cento generi dei gruppi dei batteri intestinali. Forniva, pertanto, un grande potenziale per una migliore comprensione del microbiota gastrointestinale umano, per identificare l'effetto del tempo o dei cambiamenti nella dieta e per confrontare gruppi d’individui differenti per lo stato di genotipo o di salute, di età, di origine geografica o di qualsiasi altro fattore rilevante, potenzialmente coinvolto nella formazione di questo ecosistema di enorme importanza. Questa prima applicazione dell’HITChip per il confronto del microbiota tra giovani e adulti mostrava, peraltro, notevoli differenze e forniva nuove conoscenze sugli effetti dell'invecchiamento sul microbiota intestinale umano.
Marcus J. Claesson dell’University College Cork – Ireland e collaboratori, commentando che le alterazioni nella composizione del microbiota intestinale erano associate a diverse patologie croniche, tra cui l'obesità e le malattie infiammatorie e considerando la maggiore variabilità individuale degli anziani rispetto ai giovani adulti, hanno studiato 178 soggetti di tarda età in rapporto alla loro condizione di soggiorno in comunità, in day-hospital, in riabilitazione o in assistenza residenziale a lungo termine (Nature, Volume:488,Pages:178–184 (09 August 2012). La composizione del microbiota correlava significativamente con le misure di fragilità, di comorbilità, di stato nutrizionale, del livello dei marcatori dell’infiammazione e con i metaboliti del diluito fecale. Il microbiota individuale delle persone in soggiorno di lunga assistenza era significativamente meno diversificato, rispetto a quello dei residenti in comunità. La condizione di confino in comunità correlava il microbiota con una maggiore fragilità. Nell’insieme i dati confermavano una relazione tra la dieta, il microbiota e lo stato di salute. Derivava anche l’indicazione del ruolo della dieta sulle alterazioni nell'invecchiamento del microbiota nei vari tassi del declino della salute.
I principali batteri del microbiota intestinale dell’uomo
La descrizione completa del microbiota umano e il suo rapporto con la salute e la malattia si sono già dimostrati una delle principali sfide nel XXI° secolo. In effetti, l’elenco delle pubblicazioni per anno su tale argomento si è espanso notevolmente nell’ultimo decennio e già nel 2011 sono state contate in letteratura citazioni in numero quattro volte maggiore rispetto al 2005.
Recenti evidenze hanno indicato che i batteri fecali coltivabili rappresentano solo una frazione di quelli effettivamente presenti nell'intestino. L'applicazione delle nuove tecnologie, indipendenti dalla coltura, ha anche rivelato che la diversità della flora intestinale fecale era considerevolmente maggiore del previsto. Negli studi la proporzione delle specie non descritte variava dal 30 al 90%. Alcune sequenze di rRNA 16S hanno, poi, indicato la presenza di specie non descritte strettamente connesse a quelle note e di altre specie o generi con lontana parentela con batteri noti. Tutto ciò forse in ragione del gran numero di substrati fermentabili disponibili nel tratto gastrointestinale. In effetti, i principali elementi disponibili per i batteri del colon umano sono i carboidrati alimentari sfuggiti alla digestione nel piccolo intestino. In particolare, sono amidi resistenti, fibre alimentari, come cellulosa, emicellulosa, pectina, inulina, zuccheri non assorbiti e polialcoli. Tuttavia, anche le proteine della dieta e quelle degli enzimi pancreatici e delle secrezioni gastrointestinali possono contribuire in una certa misura al pabulum dei batteri intestinali. Inoltre, anche il muco prodotto dall'ospite e le cellule epiteliali esfoliate rappresentano altri substrati potenziali.
In effetti, la fermentazione dei polimeri complessi, quali i polisaccaridi e le proteine, richiede nel colon la cooperazione di differenti gruppi di popolazioni microbiche. La suddivisione inizia con la depolimerizzazione dei carboidrati complessi e delle proteine, dando origine ai composti mono e oligomerici che, a loro volta, possono subire un’ulteriore frammentazione sino agli SCFA (short-chain fatty acids), come l’acetato, il propionato, il butirrato con formazione anche di anidride carbonica e idrogeno molecolare. L’acido lattico, il succinico, l’etanolo, e il formiato costituiscono gli importanti composti intermedi, anch’essi degradati a SCFA, CO2 e H2. Le proteine sono segmentate in peptidi e aminoacidi, la cui fermentazione provoca anche la formazione di SCFA, CO2 e H2. Inoltre, si formano acidi grassi a catena ramificata, ammoniaca, solfuro d’idrogeno, ammine, fenoli, indoli e mercaptani.
Gli studi sulle caratteristiche della presenza dei germi del microbiota intestinale umano riportano il dominio dei cinque phyla batteri: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria e Verrucomicrobia e un Archaea, l’Euryarchaeota. I gruppi meno prevalenti sono tra i cianobatteri, i Fusobacteria, le Lentisphaerae, le spirochete e i TM7. I Firmicutes sono un phylum di batteri gram positivi che contengono generi significativi, compresi il Ruminococcus, il Clostridium, il Lactobacillus, di cui diversi ceppi sono probiotici, l’Eubacterium produttore di butirrato, il Faecalibacterium e la Roseburia. Nella famiglia delle Batteroidacee i Bacteroides, la Prevotella e lo Xylanibacter degradano una varietà di glicani complessi. Gli Attinomiceti phylum comprendono la Collinsella e il Bifidobacterium, che contiene ceppi probiotici. I Proteobacteria comuni sono l’Escherichia della famiglia delle Enterobacteriaceae e il Desulfovibrio, che include batteri che riducono il solfato. I Verrucomicrobia sono stati di scoperta più recente e comprendono gli Akkermansia, specializzati nella degradazione del muco. Gli Euryarchaeota contengono prevalentemente il Methanobrevibacter, coinvolto nella continuazione della metanogenesi intestinale.

Le tecniche filogenetiche di DNA microarray, basate sulla microibridazione contemporanea di migliaia di specifici frammenti di DNA come supporto solido recante una successione ordinata di migliaia di microscopici spot, contenenti ognuno poche picomoli di uno specifico frammento con una precisa sequenza, sono tra le principali tecniche molecolari complete che consentono analisi di alta produttività degli ecosistemi microbici. Possono essere anche utilizzate per la tipizzazione del ceppo, della determinazione della diversità e dell'analisi della funzionalità microbica. Questi microarray filogenetici sono, nella maggior parte dei casi, basati sulla piccola subunità ribosomiale RNA (SSU rRNA) del gene. Possono, pertanto, essere utili per la caratterizzazione della composizione e delle dinamiche del microbiota intestinale umano. In tal modo, più del 60% delle diversità attualmente note dei filotipi della flora intestinale si è rilevato con le sequenze geniche 16S rRNA. Invece, meno del 40% è stato dimostrato dai processi di coltura. Peraltro, l'analisi comparativa con altre metodologie, come il pirosequenziamento, dimostra che questa tecnica è robusta e altamente riproducibile.
Pur tuttavia, utilizzando metodi di sequenziamento tradizionali, la stima delle comunità batteriche del microbiota è, invero, a causa del loro costo elevato molto impegnativa. Pertanto, l'attenzione si è spostata rapidamente verso sequenziamenti con tecnologie di più recente generazione. In effetti, la maggior parte dei batteri condivide alcune regioni nel gene 16S rRNA che si affiancano in più variabili segmenti. Questi, quindi, possono essere utilizzati come impronta digitale di determinate specie batteriche. La reazione a catena della polimerasi (Polymerase Chain Reaction), comunemente nota con l'acronimo PCR, è una tecnica di biologia molecolare che consente la moltiplicazione, o meglio l’amplificazione dei frammenti degli acidi nucleici dei quali si conoscano le sequenze nucleotidiche iniziali e terminali. In tal modo, quindi, si possono ottenere in vitro molto rapidamente le quantità di materiale genetico necessarie per le successive applicazioni.
La PCR real time, denominata anche PCR quantitativa o PCR quantitativa in tempo reale (rtq-PCR), è un metodo di amplificazione e quantificazione simultanea del DNA. Essa è in grado di misurare in tempo reale la concentrazione iniziale di una sequenza stabilita in un campione biologico, quantificando il DNA dopo ogni turno di amplificazione. Il DNA è amplificato e dopo ogni turno quantificato dalle reazioni a catena della DNA-polimerasi. I metodi comuni di quantificazione ricorrono all'uso delle colorazioni fluorescenti che intercalano con il doppio filamento del DNA (ds) e con i suoi oligonucleotidi modificati, denominati sonde. Queste ultime, una volta ibridate con un DNA, diventano fluorescenti. Spesso, per quantificare i livelli di espressione degli specifici RNA, si usa combinare la PCR Retro Trascrizionale (RT-PCR), così che in una tipica reazione il prodotto si raddoppia a ogni ciclo dell'amplificazione. La retro-trascrizione, o trascrizione inversa, produce del DNA complementare a ogni singolo filamento, detto cDNA o complementary DNA, mantenendo i relativi rapporti inalterati di concentrazione delle diverse specie degli RNA. In tal modo, si rende possibile la misura dell'espressione relativa di un gene in un particolare momento, o in una cellula o in uno specifico tessuto. La combinazione di queste due tecniche è spesso denominata RT-PCR quantitativa.
Nei cicli finali, però, i substrati di reazione iniziano a scarseggiare e i prodotti della PCR a non raddoppiare. Così che, la curva tende ad appiattirsi. Il punto sulla curva in cui la quantità di fluorescenza comincia ad aumentare velocemente, solitamente alcuni scarti quadratici medi sopra la linea di base, è chiamato ciclo soglia o valore di Ct. Il diagramma del Ct sullo stampo del DNA è lineare. In tal modo, confrontando i valori del Ct fra reazioni multiple si può calcolare la concentrazione dell'acido nucleico che si vuole quantificare. Inoltre, la pendenza di questa linea offre anche una misura dell’efficienza della PCR. Si può effettuare una quantificazione assoluta delle concentrazioni degli specifici DNA o RNA, producendo una curva standard di calibrazione. In forma alternativa, una quantificazione relativa può ottenersi rapportando la loro quantità, rispetto a quella di un gene di controllo. In conformità a quanto riportato, può assumersi che la PCR real time rappresenta un innovativo sistema di rilevamento e di misurazione del DNA amplificato in tempo reale con riduzione del numero delle repliche necessarie alla determinazione di ogni campione. In tal modo, vengono anche superate tutte le manipolazioni successive all’amplificazione, potenziale motivo di alterazione dei risultati. In definitiva, nel confronto con le PCR tradizionali i vantaggi di precisione e d’intervallo di quantificazione risiedono nella possibilità di quantificare il DNA al ciclo soglia. Esso, in effetti, è sempre calcolato nella fase esponenziale della reazione PCR in cui i reagenti sono ancora lontani dall’esaurimento e, quindi, con gli elementi di variabilità ridotti al minimo.
Lu Cheng dell’University of Helsinki – Finland e collaboratori, hanno proprio puntualizzato l’importanza della stima della composizione batterica di una comunità di un campione misto nei diversi contesti applicativi dei microbiologi. Hanno anche ribadito che essa era comunemente ottenuta con la reazione a catena della polimerasi di clustering amplificato delle sequenze geniche 16S rRNA (Nucleic Acids Research, 2012, Vol. 40, No. 12, 5240–5249). Purtroppo, questi correnti metodi di clustering per l'analisi di queste sequenze dipendenti dalla tassonomica, come l’UCLUST, l’ESPRIT-Tree e il CROP, avevano due limitazioni:
1)la necessità di conoscenze specifiche, come l’esatta indicazione della
differenza tra una specie e l’altra,
2)l’impossibilità di separare specie strettamente correlate tra loro.
La prima limitazione caricava di un gravoso onere per il notevole sforzo necessario per selezionare i parametri appropriati. La seconda, invece, portava a una descrizione imprecisa della comunità batterica sottostante la composizione.
Sulla base di tali premesse, gli Autori per superare queste limitazioni proponevano un metodo probabilistico di stima della composizione della comunità batterica. Il metodo, secondo gli Autori, avrebbe richiesto scarse conoscenze specifiche con sola indicazione del numero massimo possibile dei cluster. Anche il loro metodo dimostrava la sua capacità di separare strettamente specie correlate in due esperimenti, nonostante gli errori del sequenziamento e delle variazioni individuali.
In conclusione, quindi, gli Autori hanno sviluppato un nuovo metodo per la rilevazione della comunità batterica sulla base di 454 dati di sequenziamento. Rispetto ai metodi tradizionali, hanno potuto determinare il numero delle specie batteriche automaticamente, mentre non era necessario alcun riferimento esterno di basi dei dati. Il metodo poteva anche essere utilizzato per altri problemi che richiedevano raggruppamento di grande quantità di sequenze del DNA. Era in grado, peraltro, di separare specie strettamente correlate negli OTU (operational taxonomic unit) indipendenti.
I consorzi sul microbioma umano nel mondo
In rapporto al progressivo interesse sul microbioma umano, nel 2008 gli scienziati di tutto il mondo hanno annunciato la costituzione dell’IHMC (International Human Microbiome Consortium) per raccogliere le migliori menti e le più recenti ricerche rivolte all'obiettivo di caratterizzarne il ruolo nello stato di salute e di malattia. Il microbioma si riferisce, di fatto, ai genomi di tutti i microrganismi che albergano dentro o sul nostro corpo e, pur avendo un rapporto di numero con le cellule umane da dieci a uno, sono stati ancora non adeguatamente studiati. Ne deriva la condizione che il loro impatto sullo sviluppo umano, sulla sua fisiologia, sull’immunità e sulla nutrizione è in gran parte ancora sconosciuto. Su tale presupposto si è basata l'importanza dell’IHMC. Comunque, l’IHMC è l'ultimo di una tendenza d’iniziative di condivisione dei dati. Il NIH National Institutes of Health e l’European Commission di poco prima avevano firmato una lettera d’intenti in cui convenivano di riunire i dati del progetto microbioma umano NIH e di quello del METAHIT (EC Metagenomics of the Human Intestinal Tract). Di conseguenza, infatti, allo stato attuale entrambi i progetti contribuiscono con l’IHMC.
Questa iniziativa globale, secondo gli studiosi, deve permettere di esplorare territori ancora sconosciuti, portando alla comprensione dell’interazione tra i microbi e il nostro corpo con riflessi di ampia portata in medicina, in farmacologia, nella scienza dell'alimentazione e in molte altre discipline.

Le funzioni metaboliche del microbiota intestinale
Le funzioni metaboliche del microbiota intestinale comprendono la produzione delle vitamine, la sintesi degli aminoacidi e la biotrasformazione degli acidi biliari attraverso enzimi che hanno implicazioni importanti per il metabolismo del colesterolo e del glucosio. Inoltre, il microbioma fornisce percorsi biochimici necessari per la fermentazione dei substrati non digeribili e del muco endogeno. La fermentazione, peraltro, stimola la crescita batterica producendo gas e acidi grassi a catena corta, tra cui i principali sono l’acetato, il butirrato e il propionato. Altri prodotti finali batterici includono il lattato, l’etanolo, il succinato, il formiato, il valerato, il caproato, l’isobutirrato, il 2-metil-butirrato e l’isovalerato. La fermentazione batterica è presente nel cieco e nel colon, dove gli acidi grassi a catena corta vengono assorbiti stimolando l'assorbimento dei sali e dell’acqua. Una proprietà di questi acidi grassi è costituita dal loro effetto trofico sull’epitelio intestinale. Il butirrato, peraltro, è la fonte energetica preferita dalle cellule epiteliali ed è quasi completamente eliminato dall’epitelio del colon. Nel colon l’acetato rappresenta la principale forma di acidi grassi a catena corta e anche il substrato primario per la sintesi del colesterolo. Per altro verso, il propionato, aggiunto alla dieta come integratore, ha dimostrato di ridurre i livelli di colesterolo in vivo. Tutto questo sta a confermare il valore essenziale delle molteplici attività metaboliche della flora intestinale per il metabolismo dell’ospite.
È stato rilevato, comunque, che un’alimentazione ricca in carboidrati non glicemici, quelli denominati in passato fibre alimentari, favorisce la colonizzazione dei Lattobacilli e dei Bifidobatteri. I primi sono anche denominati fermenti lattici per la loro proprietà di produrre acido lattico dalla fermentazione dei substrati zuccherini. La loro quota nella normale microflora è di solito scarsa e inferiore di alcuni ordini di grandezza a quella dei Bifidobatteri. Questi ultimi producono acido acetico e lattico e sono meno presenti nei preparati probiotici, perché deperibili. Presentano, però, il vantaggio di superare meglio la barriera gastrica. Di converso, una dieta ricca di grassi e carne apre le porte ai batteri, cosiddetti putrefattivi, con possibilità di produzione di sostanze cancerogene. Pur tuttavia, i cambiamenti, anche drastici, della dieta non condizionano in genere marcate variazioni del microbiota intestinale. In effetti, i batteri, potendo utilizzare diversi nutrienti come substrato, dimostrano abbastanza sufficientemente e rapidamente di adattarsi alle modificazioni dietetiche dell’ospite. Da quanto riportato si evince, comunque, che i probiotici per essere efficaci, devono poter colonizzazione nell’intestino e, quindi, devono raggiungerlo in quantità sufficientemente elevata e avere un tasso di crescita adeguato per competere con la flora batterica già residente.
Pur tuttavia, per effetto del metabolismo batterico si ottengono condizioni positive, come l’idrolisi delle proteine a peptidi e ad aminoacidi, quella dei lipidi e la produzione delle vitamine. Possono, però, combinarsi altre funzioni, come l’inattivazione di alcuni farmaci e la produzione di metaboliti tossici o cancerogeni. Per tutto quanto considerato, nel microbiota residente vengono distinti batteri utili, dannosi e indifferenti.
La normale microflora impedisce ai batteri patogeni di colonizzare l’intestino, opponendo con un effetto di barriera la resistenza alla colonizzazione. Tutto ciò si realizza con meccanismi indiretti, come l’aumento della velocità del transito e la modulazione del sistema immunitario, e con effetti diretti. Questi ultimi, tesi a contrastare la colonizzazione di altri germi nell’intestino, si basano su:
- La competizione per i nutrienti e per gli spazi.
- L’amensalismo, detto anche competizione asimmetrica, per interazione con cui s’impedisce o si diminuisce il successo di un'altra specie, senza però allo stesso tempo trarne vantaggi o svantaggi. Ciò può accadere se si secerne una sostanza chimica come parte del proprio normale metabolismo, ma con effetto negativo su un secondo microrganismo. Ad esempio, gli acidi grassi a catena corta, prodotti dai batteri anaerobi obbligati, inibiscono la crescita degli aerobi facoltativi e della Salmonella e di altri batteri patogeni.
- L’effetto predatorio, quando una specie microbica consuma un’altra di dimensioni più piccole.
- Il parassitismo, quando un tipo di batteri ne uccide un altro di dimensioni maggiori, come nel caso dei batteriofagi infettanti altri batteri.
In tutto questo i fattori ambientali, come il clima e la temperatura, e le caratteristiche e i comportamenti dell’ospite, come l’età, il sesso, lo stress e l’attività fisica, hanno, di certo, influenza sulla microflora intestinale, ma gli studi nei meriti non sono ancora conclusivi. Invero, l’antibioticoterapia rappresenta la principale causa della sua alterazione. Essa, difatti, procura spesso colite nel 5-30% dei casi o diarrea. A tale riguardo, è sempre opportuno suggerire la raccomandazione di mantenere una corretta microflora intestinale, ricordando che la riduzione dei batteri utili permette la presenza delle specie patogene con l’innesco d’infezioni, non solo locali, ma anche extraintestinali in altri organi.
Il tratto gastrointestinale umano contiene, quindi, circa 1014 microbi che in primo luogo abitano il colon e che rappresentano oltre 1.000 varietà batteriche. Storicamente il profilo della flora intestinale è stato attentamente esaminato come organo strettamente legato al benessere fisico, con alcuni ceppi rivolti alla promozione della salute e altri alle malattie. Così che, oltre al suo ruolo nello stabilire e mantenere la normale salute intestinale, il microbiota è stato riconosciuto dotato di azione potenziale per il miglioramento o l’aggravamento di numerose malattie, dal cancro del retto sino alle malattie autoimmuni e allergiche.
A tale proposito, i livelli più elevati di Faecalibacterium prausnitzii si sono trovati nei soggetti sani e non nei pazienti affetti da colite. Inoltre, la colonizzazione del Bacteroides fragilis in topi liberi da germi produce PSA (polysaccharide A), che modula positivamente la risposta immune delle cellule T dell'ospite. Una disbiosi intestinale è stata dimostrata nell’obesità e nelle sue associate comorbidità per una riduzione dei Bacteroidetes e un aumento dei Firmicutes. Peraltro, la perdita di peso aumenta la proporzione dei Bacteroidetes, rispetto ai Firmicutes. Inoltre, una prova indiretta di quest’associazione è offerta dall’aumentata concentrazione dell’etanolo nel respiro degli obesi, correlata verosimilmente alla microflora intestinale, come dimostrato nei topi obesi, rispetto ai magri. In effetti, è stato dimostrato che tale dato non era più apprezzabile dopo la somministrazione orale di antibiotici.
Michael Blaut e Thomas Clavel del German Institute of Human Nutrition (DIfE) Nuthetal, Germany, ribadendo che i batteri che colonizzano il tratto intestinale umano presentano un’elevata diversità filogenetica che riflette il loro immenso potenziale metabolico, hanno discusso sull’impatto importante che essi hanno in virtù della loro attività catalitica sulla funzione gastrointestinale e salute dell'ospite (J. Nutr. 137: 751S-755S, 2007). Tutti i componenti della dieta che sfuggono alla digestione nell'intestino tenue sono substrati potenziali dei batteri presenti nel colon. La conversione batterica dei carboidrati, delle proteine e dei composti non nutritivi, come le sostanze polifenoliche portano alla formazione di un gran numero di composti che possono avere effetti positivi o negativi sulla salute umana. L'apparato digerente umano è importante non solo per l’assorbimento dei nutrienti, ma anche perché ospita una comunità di microrganismi principalmente anaerobi. Sotto quest’ultimo aspetto, le condizioni nelle varie sezioni del tratto gastrointestinale differiscono notevolmente. Ciò riflette la distribuzione irregolare delle cellule batteriche, con basse concentrazioni nello stomaco e duodeno, fino alle 103 unità formanti colonie (ufc) 3 per millilitro (ufc × mL-1), per aumentare nel digiuno e nell’ileo dalle 104 alle 108 ufc × mL-1. La concentrazione massima si ha nel colon con 109-1012 cfu × mL-1. La composizione della flora batterica intestinale è relativamente semplice nei bambini ma aumenta di complessità con lo svolgere dell'età, raggiungendo un elevato grado negli adulti. Tra gli individui umani, comunque, vi è un alto grado di variabilità a livello di specie o ceppi batterici. La dieta è uno dei principali determinanti per la persistenza nel tratto gastrointestinale di un dato batterio, perché essa fornisce nutrienti non solo per l'ospite, ma anche per i germi che lo abitano. Le componenti alimentari non digeribili servono come fonti di energia e di carbonio per i batteri intestinali umani. La dieta, comunque, ha un effetto indiretto sulla funzione gastrointestinale dell'ospite, e quindi sulla salute, proprio per il fatto di influenzare la composizione e l'attività della flora intestinale. I batteri intestinali influenzano la maturazione e la manutenzione del sistema immunitario, influenzano la proliferazione cellulare e contribuiscono al recupero di energia. Inoltre, come detto, la flora batterica intestinale ha un grande potenziale catalitico, che può portare alla formazione di metaboliti con effetti benefici o negativi sulla salute.
Dal loro canto, Kemin Tan dell’Argonne National Laboratory, Illinois – USA e collaboratori, considerando che nel microbioma intestinale umano l'arricchimento in certe proteine dei geni sembra essere diffuso, comprendendo gli enzimi coinvolti nel metabolismo dei carboidrati, hanno riportato la struttura di una α-glucosidasi ricombinante umana del batterio intestinale Ruminococcus obeum (October 2010 The FASEB Journal vol. 24 no. 10 3939-3949). Le prime strutture in assoluto delle proteine di questo batterio rivelavano una struttura omologa alla maltasi glucoamilasi intestinale umana con un dominio catalitico altamente conservato e domini ausiliari ridotti. L'α-glucosidasi, membro della famiglia GH31, mostra preferenza di substrato per i legami α (1-6) sopra l’α (1-4) glicosidici e produce glucosio da isomaltosio e maltosio. La preferenza può essere commutata da una singola mutazione al suo sito attivo, suggestiva da parte dei microrganismi di adattamento diffuso all'utilizzazione, come risorse di energia, di una varietà di polisaccaridi intestinali.
Microbiota intestinale e metabolismo degli acidi biliari
Sotto altro aspetto è bene ricordare le possibili interferenze della flora batterica intestinale con il metabolismo degli acidi biliari. Queste sostanze sono prodotte negli epatociti, si accumulano in riserva nella cistifellea e sono rilasciate nel duodeno in occasione della digestione per facilitare l'assorbimento di trigliceridi, del colesterolo e delle vitamine liposolubili. In gran parte, più del 95%, sono riassorbiti dallo stesso intestino, soprattutto per trasporto attivo mediato dalla bile IBAT (ileal bile acid transporter), noto anche come ASBT o SLC10A2, ma anche mediante diffusione passiva nella parte superiore dell'intestino tenue e nel colon. Questa efficiente circolazione enteroepatica degli acidi biliari è regolata da un feedback negativo con stretto controllo della loro sintesi. Gli acidi biliari non solo regolano la loro stessa biosintesi, ma modulano anche le importanti vie metaboliche che coinvolgono le lipoproteine, il glucosio, i farmaci e il metabolismo energetico attraverso l'attivazione di recettori nucleari quali il FXR (farnesoid X receptor) e il TGR5 (the G protein-coupled receptor). Gli acidi biliari sono sintetizzati dal colesterolo attraverso un processo che richiede azioni concertate di almeno quattordici enzimi epatici. Gli esseri umani sintetizzano il CA (cholic acid) e il CDCA (chenodeoxycholic acid), mentre i topi sintetizzano il CA e il BMCA (b-muricholic acid). Gli acidi biliari sono successivamente coniugati con la glicina, predominante nell'uomo, o con la taurina, più presente nei topi. L’enzima CYP7 A1 (cholesterol 7a-hydroxylase) avvia il percorso classico per la sintesi degli acidi biliari, e il CYP27A1 inizia la via alternativa. Per la sintesi del CA è, comunque, richiesta la presenza di CYP8B1 (Sterol 12a-hydroxylase). Gli enzimi che catalizzano le idrossilazioni sei e sette per produrre BMCA non sono stati ancora caratterizzati. L’espressione epatica di CYP7A1 e CYP8B1 è regolata dallo FXR, altamente espresso sia nel fegato sia nell’ileo. Sebbene il CYP7A1 e il CYP8B1 possano essere regolati dall’attivazione epatica dello FXR attraverso i recettori nucleari, gli SH (small heterodimer partner) e lo LRH-1 (liver receptor homolog-1), dati recenti suggerirebbero che lo FXR intestinale regolerebbe il CYP7A1 epatico attraverso un meccanismo dipendente dallo FGF15 (fibroblast growth factor 15).
È ormai ben noto che la flora intestinale ha consistenti effetti sul metabolismo degli acidi biliari. Difatti, ne promuove la deconiugazione, la deidrogenazione e la deidrossilazione nell’intestino tenue e nel colon distale, aumentando così la loro diversità chimica. Studi sperimentali sui ratti hanno anche dimostrato che il microbiota intestinale riduce le dimensioni del pool degli acidi biliari con il suo più grande effetto sulla BMCA, piuttosto che su quelli del CA. Tuttavia, i meccanismi molecolari con cui la flora intestinale sopprime la sintesi degli acidi biliari sono tuttora sconosciuti.
Sama I. Sayin dell’University of Gothenburg – Sweden e collaboratori hanno confermato una drammatica riduzione dei livelli di acido muricolico, ma non di colico, in topi CONV-R (conventionally raised). La riderivazione nei topi carenti in FXR, come GF (germ free), dimostrava che il microbiota intestinale regolava l’espressione dello FGF15 nell'ileo e il CYP7A1 (cholesterol 7a-hydroxylase) nel fegato attraverso meccanismi dipendenti dallo FXR. Gli Autori rilevavano anche l’importanza di aver identificato acidi tauroconiugati beta e alfa come antagonisti muricolici dello FXR (Cell Metabolism 17, 225–235, February 5, 2013).
In conclusione, i risultati suggerivano che la flora intestinale non solo regolava il metabolismo degli acidi biliari, ma ne inibiva anche la sintesi nel fegato, attenuando l'inibizione dello FXR nell'ileo.
Pertanto, i risultati chiave erano che:
- La flora intestinale riduceva le quantità biliari e la composizione del pool degli acidi.
- La flora intestinale attivava lo FXR attenuando l’antagonismo del recettore.
- Gli acidi muricolici tauroconiugati erano naturali antagonisti dello FXR.
Tutto questo portava a considerare che il colesterolo, principalmente sintetizzato dall’organismo e fattore di rischio per le malattie cardiovascolari, ma anche ottenuto dalle fonti alimentari, subisce una trasformazione epatica in acidi biliari, poi secreti nell’intestino e rimossi dal corpo o riciclati nello stesso fegato.
Quindi, lo studio si rilevava importante per aver dimostrato che i batteri intestinali regolano la formazione degli acidi biliari a partire dal colesterolo.
Peraltro, il recettore FXR non è implicato nel solo metabolismo del colesterolo, ma anche in quello dello zucchero e dei grassi.
Microflora e motilità gastrointestinale
Le interazioni tra il microbiota e la motilità gastrointestinale può essere evidente sin dalle prime fasi della vita. Gli aspetti di sviluppo del microbiota sono anche d’interesse clinico, data l'importanza degli eventi precoci di vita per la fisiopatologia dei disturbi come la sindrome dell'intestino irritabile (IBS). Come detto in precedenza, alla nascita l'intero tratto intestinale è sterile. I batteri che entrano nell'intestino con l’alimentazione della prima infanzia, nel seguito degli anni successivi rimangono pressoché relativamente costanti nella loro composizione. I modelli di fisiologia neuromuscolare del sistema gastroenterico evolvono contemporaneamente ai fenomeni di maturazione del microbiota. Quando questi modelli sono disturbati, il microbiota ha una notevole capacità di ripristinarsi e tornare nello stesso stato precedente. Pur tuttavia, nella fase formativa dell’evoluzione dei primi anni di vita del bambino è possibile che le alterazioni del microbiota possano avere conseguenze permanenti. Per esempio, si è ipotizzato a tal proposito che l'uso di antibiotici nella prima infanzia possa costituire un fattore di rischio di sviluppo della malattia infiammatoria intestinale nel proseguimento della vita.
Peraltro, i rapporti tra la motilità gastroenterica e il microbiota sono evidenti a livello del normale intestino. Infatti, è a causa della presenza di tali schemi di motilità normali, come la peristalsi e il complesso motore di migrazione di concerto con gli effetti antimicrobici dell’acido gastrico, che lo stomaco e l'intestino tenue prossimale dei soggetti sani contengono un numero relativamente piccolo di batteri. Le culture digiunali possono, infatti, non rilevare eventuali batteri in circa il 33% dei casi. Il rapporto tra l'integrità del complesso motore di migrazione e l'assenza della SIBO (small intestinal bacterial overgrowth) è stato, infatti, descritto per prima nell'uomo quasi trentacinque anni fa (Vantrappen G, J Clin Invest. 1977;59:1158–1166). La microbiologia dell'ileo terminale rappresenta, a suo modo, una zona di transizione tra la prevalenza di anaerobi facoltativi del digiuno e la densa popolazione di anaerobi del colon. Così che, la conta delle colonie batteriche può essere di 1 × 109 CFU / mL nell'ileo terminale, immediatamente prima della valvola ileocecale con prevalenza di batteri Gram-negativi e anaerobi. Lungo il colon, la concentrazione batterica e la varietà della flora enterica cambiano radicalmente. Gli schemi specializzati di motricità dell’ileo terminale, dove il complesso motore di migrazione è meno evidente nell’uomo, come pure le proprietà fisiologiche e bio-meccaniche della giunzione ileo-colica, senza dubbio contribuiscono a questi gradienti batterici in questa sede. Si possono trovare nel colon concentrazioni batteriche fino a 1 × 1012 CFU / ml, principalmente composte di anaerobi, come Bacteroides, Porphyromonas, Bifidobacterium, Lactobacillus e Clostridium. Peraltro, i batteri anaerobici superano in numero quelli aerobici per un fattore di 100-1.000:1. La predominanza degli anaerobi nel colon riflette che la concentrazione di ossigeno è molto bassa in questa sede e il microbiota si è, quindi, semplicemente adattato a sopravvivere in quest’ambiente.
Gli FGIDs (Functional gastrointestinal disorders) sono definiti, in assenza di altre patologie, da criteri diagnostici basati sui sintomi cronici o ricorrenti di pertinenza del tratto gastrointestinale. Essi per gli adulti sono classificati in sei categorie principali: esofagee, gastroduodenali, intestinali, la sindrome del dolore funzionale addominale, la biliare e l’anorettale. Di tutte queste gli FBD costituiscono per la ricerca di cure sanitarie uno dei motivi più comuni e sono associati a una cattiva salute, a bassa qualità della vita e a notevoli costi sociali. I meccanismi fisiopatologici alla base di questi disturbi non sono completamente noti. Di certo, però, possono contribuire: la motilità anormale gastrointestinale (GI), l’ipersensibilità viscerale, gli alterati rapporti funzionali cerbrointestinali, l’infiammazione di basso grado, i disturbi psico-sociale, i microbi intestinali.
Diverse evidenze hanno dimostrato il coinvolgimento dei batteri intestinali nella patogenesi e nella fisiopatologia degli FBD, attraverso le capacità metaboliche del microbiota luminale e la sua potenzialità nell’influenzare l'ospite tramite le interazioni microbi/sistema immune. In effetti, molti soggetti con sindrome dell'intestino irritabile (IBS) sperimentano l’insorgenza della sintomatologia a seguito di un’infezione enterica. Peraltro, trattamenti diretti sulla flora intestinale hanno anche dimostrato effetti positivi nei pazienti con FBD. Inoltre, la SIBO (small intestinal bacterial overgrowth) e le alterazioni in generale del microbiota intestinale sono implicate in sottogruppi di pazienti con FBD.
La motilità intestinale, comunque, ha dimostrato di essere influenzata da una varietà di componenti e prodotti batterici. Infatti, il potenziale degli acidi grassi a catena corta, di altri metaboliti batterici e dei sali biliari deconiugati ha ampiamente dimostrato di generare potenti risposte motorie, sia nel modello animale e sia nell’uomo. Gli effetti dei sali biliari potrebbero essere rilevanti per la diarrea dei sali biliari, un fenomeno che ha recentemente goduto di una rinascita come fattore nell’eziologia della IBS con predominante diarrea. Nello stesso tempo ha anche portato all’esplorazione dei sali biliari come intervento di terapia nell’IBS con predominante costipazione. In altri studi, le modifiche sul microbiota indotte dai cambiamenti nella dieta hanno dimostrato di alterare gli schemi di motricità del duodeno e del digiuno. Da notare, che la fermentazione dei carboidrati non assorbiti è in funzione della flora batterica intestinale. Quindi, le modifiche quantitative del volume dei gas potrebbe essere tale da suscitare risposte riflesse indotte dai cambiamenti di distensione e anche qualitativi in rapporto alla sovrapproduzione di metano. Tali fattori, infatti, hanno dimostrato di inibire direttamente l’attività motoria. In effetti, l’abnorme gas è stato identificato come un fattore nella patogenesi della distensione e del gonfiore nella sindrome del colon irritabile. Pur tuttavia, non è ancor nota la modalità con cui il microbiota contribuisce a questo fenomeno. Inoltre, il fatto che una modificazione della flora batterica può portare nell'uomo a cambiamenti della fermentazione intestinale è stato ampiamente dimostrato. Difatti, sia utilizzando un prebiotico sia aumentando selettivamente il numero dei bifidobatteri, o integrando direttamente con i bifidobatteri si riduceva la fermentazione nel colon. Peraltro, i cambiamenti della funzione motoria influenzano la fermentazione, non solo nel colon, ma anche in sedi molto distanti come l’esofageo e lo stomaco.
Ciò nonostante, mentre gli effetti microbici sulla funzione neuroendocrina della mucosa intestinale sono stati da qualche tempo riconosciuti, solo di recente è stata identificata la capacità di molecole complesse del microbiota con potenzialità di influenzare la motricità intestinale e la sua funzione sensoriale. Alcune specie, poi, hanno dimostrato di elaborare peptidi neurotrasmettitori, così come il neurotrasmettitore inibitorio del gas e dell’ossido nitrico. È stato anche dimostrato lo sconvolgimento da parte degli antibiotici sulla flora batterica e l’aumento dell’immunoreattività alla sostanza P e d’induzione dell’ipersensibilità del colon. Al contrario, alcuni ceppi commensali hanno dimostrato la capacità di modulare il dolore intestinale attraverso l'induzione di oppioidi e dei recettori dei cannabinoidi.
Barbara G dell’Univeristy of Bologna - Italy e collaboratori hanno proprio discusso la partecipazione attiva dei batteri commensali dell'intestino umano allo sviluppo e al mantenimento delle funzioni sensoriali e motorie del tratto gastroenterico, compresa la promozione dell’attività propulsiva intestinale (Am J Gastroenterol. 2005 Nov;100(11):2560-8). D'altra parte, quest’ultima attività rappresenta uno dei principali mezzi per il controllo della microflora intestinale, attraverso la radicale evacuazione delle eccessive quantità di batteri dal lume.
Nella loro revisione gli Autori identificavano tre meccanismi con cui la flora batterica intestinale poteva influenzare la funzione della motricità intestinale:
- attraverso il rilascio di sostanze batteriche o prodotti finali della fermentazione batterica,
- attraverso fattori neuroendocrini intestinali,
- indirettamente, attraverso gli effetti della mediatrice rilasciati dalla risposta immunitaria intestinale.
Simrén M dell’University of Gothenburg – Sweden e collaboratori, ribadendo che si pone oramai sempre maggiore attenzione sulle interazioni tra intestino dell’ospite e varietà microbiche che lo abitano, hanno voluto puntualizzare gli elementi più importanti nella patogenesi dei disordini funzionali gastrointestinali (FGID) (Gut. 2013 Jan;62(1):159-76). Gli Autori hanno fornito, così, una revisione critica delle ipotesi attuali per quanto riguarda il coinvolgimento patogenetico del microbiota nel FGID e hanno valutato i risultati degli interventi diretti sul microbiota. Hanno anche fornito una guida clinica sulla modulazione del microbiota intestinale nell’IBS.
La prova più convincente fino ad oggi è la constatazione che la dispepsia funzionale e la sindrome dell'intestino irritabile (IBS) possono svilupparsi in soggetti predisposti a seguito di un attacco di gastroenterite infettiva. C'è stato anche un grande interesse per le potenziali implicazioni cliniche e terapeutiche della SIBO (small intestinal bacterial overgrowth) nell’IBS. Tuttavia, questa teoria ha generato un ampio dibattito perché la prova è in gran parte basata sui test del respiro che non sono stati convalidati. L'introduzione delle tecniche molecolari indipendenti dalla cultura ha fornito allo stato attuale un importante passo avanti per la comprensione della comunità microbica nella FGID. I risultati sui profili del 16S rRNA del microbiota hanno dimostrato i cambiamenti sia quantitativi sia qualitativi della mucosa e della flora intestinale e fecale, in particolare nell’IBS. Gli investigatori stanno anche iniziando a misurare le interazioni ospite-microbiche nell’IBS. L'attuale ipotesi di lavoro è che la flora batterica anomala possa attivare le risposte immunitarie innate della mucosa, aumentando la permeabilità epiteliale, attivando vie nocicettive e sensoriali e disregolando il sistema nervoso enterico. Mentre siamo in attesa d’intuizioni importanti in questo campo, il microbiota è già un obiettivo terapeutico. Gli attuali studi controllati di manipolazione alimentare, i prebiotici, i probiotici, i simbiotici e gli antibiotici non assorbibili costituiscono già basi promettenti. Tutto ciò anche se la maggior parte delle promesse sono limitate per la progettazione non ottimale e la piccola dimensione del campione.
Metano intestinale e indice di massa corporea
Nei modelli animali una particolare alterazione della microflora, associata all’aumento del peso, è costituita dalla presenza dell’Archaea metanogenica e specificamente dal Methanobrevibacter smithii. Comunque, i metanogeni sono comuni nella normale flora enterica umana e il M. smithii costituisce la specie più comune. I metanogeni, peraltro, hanno dimostrato d’influenzare le quote caloriche aumentando la capacità dei batteri che si nutrono di polisaccaridi, digerendo, in particolare, i glicani contenenti polifruttosio. Tale dato di fatto porta, invero, a un aumento del peso dei topi. Altri studi nei modelli in vivo hanno dimostrato che il gas metano rallenta del 59% il transito intestinale prossimale. Questo rallentamento può contribuire all’incremento del peso, poiché aumenta il carico totale del microbiota intestinale o il periodo per l’estrazione dell’energia dai pasti.
Date le associazioni nei modelli animali tra i metanogeni e l’aumento del peso, insieme con il ritrovamento di un’associazione tra il metano e il transito ritardato, questo studio ha ipotizzato che i soggetti umani con aumento delle concentrazioni di metano nell’aria espirata potrebbero presentare un incremento dei livelli di obesità, rispetto ai soggetti senza elevate concentrazioni di metano.
Robert J. Basseri della Cedars-Sinai Medical Center in Los Angeles, California e collaboratori hanno voluto verificare l’ipotesi dell’associazione tra obesità, alterati sintomi intestinali e presenza o assenza di metano nei campioni di aria espirata dei soggetti umani (Journal List >Gastroenterol Hepatol (N Y) >v.8(1); Jan 2012). Gli Autori hanno, così, reclutato, in modo prospettico dal programma di perdita di peso di un centro terziario di cure mediche, cinquantotto soggetti con un indice di massa corporea (BMI) di 30 kg/m2 o superiore.
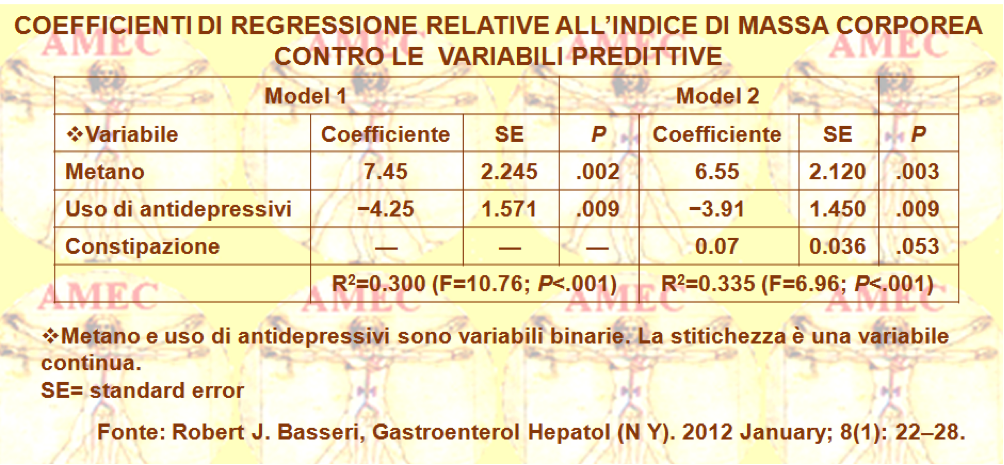
Il 20% dei pazienti, pari a dodici in numerosità, aveva al test respiratorio risultati positivi per il metano (> 3 parti per milione [ppm]), con una concentrazione media di metano nel respiro di 12,2 ± 3,1 ppm. La BMI era significativamente più alta nei soggetti metano-positivi (45.2 ± 2.3 kg/m2), rispetto ai metano-negativi (38.5 ± 0.8 kg/m2, p = .001). I metano-positivi avevano anche una maggiore severità della stipsi, rispetto ai soggetti metano-negativi (21,3 ± 6,4 vs 9,5 ± 2,4, p = 0,043). L'analisi di regressione multipla illustrava una significativa associazione tra la BMI e il metano, la costipazione e l'uso degli antidepressivi. Tuttavia, il metano rimaneva un predittivo indipendente della BMI elevata, quando controllato per l'uso degli antidepressivi (P <.001) e per la stipsi e l'uso degli antidepressivi (6,55 kg/m2 maggiore indice di massa corporea, p = .003).
In conclusione, secondo gli Autori, il loro studio era il primo sull’uomo che avesse dimostrato come una maggiore concentrazione di metano, rilevato al test del respiro, fosse un fattore predittivo di obesità significativamente maggiore nei soggetti in sovrappeso.
In definitiva, nell’intestino umano normale più del 90% della popolazione microbica totale è costituita dai Bacteroidetes e dai Firmicutes con un ruolo nell'assorbimento dei nutrienti, nella fortificazione della barriera della mucosa, nel metabolismo xenobiotico, nell’angiogenesi e nella maturazione intestinale post-natale. Il loro numero è regolato dalla dieta, soprattutto dai grassi, ed è stato riconosciuto fondamentale per lo sviluppo dell’obesità e del diabete.
Tutto, quindi, torna a ribadire la raccomandazione di mantenere una corretta microflora intestinale, tenendo principalmente presente che una diminuzione dei batteri utili rende più facile la colonizzazione delle specie patogene con una possibile infezione non solo a livello intestinale, ma anche sistemica e di altre sedi.
A tale proposito, proprio in questo mese di marzo 2013 è stata avviata una campagna informativa di Agrofarma e Simg (Società italiana di medicina generale) sulla sicurezza alimentare. Un congruo numero di medici di medicina generale del territorio nazionale ha risposto a un questionario sulle conoscenze e sui bisogni formativi sull’argomento. Ben il 95% su 965 ha fornito la giusta definizione di sicurezza alimentare, basata sulle proprietà standard dei cibi validate dalle autorità competenti e che dalla fase di produzione a quella di commercializzazione e consumo sono oggetto di verifica con un rigido sistema di controlli. D’altro canto, solo il 48%, poco meno di cinque medici su dieci, ha individuato correttamente il potenziale rischio per la salute umana delle intossicazioni da contaminazioni microbiologiche che può derivare dagli alimenti non trattati chimicamente.
D’altra parte, è emerso che il 54% dei propri assistiti dichiaravano timori nell’uso dei prodotti chimici. Essi erano, però, poco o per nulla informati sui rischi degli alimenti di produzione agricola non trattati chimicamente, come indicato dall’85% degli intervistati.
Tali risultati hanno fatto emergere che l’argomento della sicurezza alimentare rappresenta ancora oggi un tema negletto e poco conosciuto, senza la dovuta consapevolezza sui suoi rischi e dimensioni. Peraltro, ne è derivata anche l’indicazione, da parte dei medici di famiglia, di una necessità di maggiore conoscenza sugli alimenti biologici vs quelli trattati con agro farmaci, sui metodi per valutare se un cibo è sicuro, sui rischi d’intossicazione microbiologica, sui controlli effettuati sugli alimenti in Italia e sui vantaggi e svantaggi degli agro farmaci.












.png)





