NOTIZIARIO Giugno 2014 N°6
MICROFLORA INTESTINALE OGGETTO DI PREVENZIONE E CURA DELLE MALATTIE
A cura di:
Giuseppe Di Lascio §
Con la collaborazione di:
I batteri simbionti del tratto gastroenterico dell’uomo
Il corpo di un uomo sano ospita, su quasi ogni superficie corporea e in numero dieci volte superiore alle sue cellule, microrganismi, tra cui batteri, archeobatteri, virus ed eucarioti. Il metagenoma portato collettivamente da queste comunità microbiche supera in termini di dimensioni il genoma umano e la loro influenza sullo sviluppo, sulla dieta, sull'obesità, sull'immunità e sulla malattia è in fase di ricerca attiva.
L'intestino umano, in particolare, ospita il più grande e diversificato ecosistema di microbi del corpo. Esso è costituito da quasi 500 specie di batteri. Sono presenti cinque phyla e precisamente i Firmicutes, i Bacteroidetes, gli Actinobacteria, i Proteobacteria e i Verrucomicrobia. In particolare due di esse sono dominanti: i Bacteroidetes (Bacteroides, Prevotella e Xylanibacter) e i Firmicutes (Ruminococcus, Clostridium, Lactobacillus, Eubacterium, Faecalibacterium e Roseburia).

Pur tuttavia, lungo il decorso del tratto gastrointestinale, a causa dell’ambiente e dei fattori dell'ospite, le varie popolazioni presentano variazioni quantitative e qualitative. Esse, difatti, dipendono dal valore del pH, dalla peristalsi, dalla disponibilità dei nutrienti, dal potenziale di ossidoriduzione all'interno dei tessuti, dall'età e salute dell’ospite, dall'adesione, dalla cooperazione e antagonismo batterico, dalle secrezioni di muco contenenti immunoglobuline, dal tempo di transito, dalla presenza di acidi biliari e di enzimi digestivi.
Nello stomaco degli individui sani la carica batterica è bassa. Gli organismi predominanti isolati sono i lattobacilli, gli streptococchi e i lieviti.
Nel duodeno e nell’intestino tenue l'ambiente è acido con il pH tra quattro e cinque. Predominano, quindi, i lattobacilli e gli streptococchi. Il numero dei batteri nel duodeno, comunque, è superiore a quello dello stomaco con circa 102-104 CFU (unità formanti colonia) contro i 102.
Il microbiota, in rapporto alla diminuzione della velocità di transito dei contenuti e all’aumento del pH intraluminale, cambia poi fortemente dal duodeno all’ileo. Aumenta anche la carica batterica sino a 106-108 CFU.
Infine, la popolazione del microbiota del colon raggiunge i 1010-1012 CFU. In particolare, due fattori associati contribuiscono nell’intestino crasso alla massima colonizzazione fisiologica: il pH neutro e il tempo di transito più lungo.
In definitiva, un adulto può avere in totale circa 1014 CFU superando, così, in numero complessivo delle cellule eucariotiche di tutto il corpo umano.
A proposito dell’importanza crescente del microbioma è stato istituito lo HMP (microbioma Human Project), finanziato dal National Institutes of Health Common Fund per fornire una base completa della diversità microbica di diciotto siti diversi del corpo umano. Il progetto ha campionato e scoperto oltre diecimila specie diverse di microrganismi, portando all’identificazione di centinaia di migliaia di geni batterici residenti nelle diverse zone del corpo. In effetti, considerando il rapporto del genoma umano, contenente circa 22.000 geni, con la moltitudine dei batteri del microbioma, per ogni gene dell’ospite si possono contare in media quasi quattrocento geni batterici. Tutto ciò indica che l’organismo dell’uomo, oltre al genoma contenuto nel nucleo delle proprie cellule, ne ospita un altro. Ne deriva anche, che come la conoscenza del sequenziamento del genoma umano è utile per indicare i geni a rischio o a difesa da alcune malattie, così quella dei geni dell’intero microbioma può fornire le informazioni sui benefici e rischi per la nostra salute in rapporto alla sua normale o alterata presenza.
La descrizione esaustiva del microbiota umano e il loro rapporto con la salute e la malattia sono, così, considerati tra le principali sfide del XXI secolo tanto che sono in crescente aumento gli studi nei meriti per il chiarimento sempre più preciso del loro ruolo.
Jean-Christophe Lagier dell’Aix-Marseille Université, France e collaboratori per valutare l'importanza di questa sfida, hanno usato l'ISI Web of Knowledge per dimostrare il drastico rinnovato interesse degli scienziati su quest’argomento (Front Cell Infect Microbiol. 2012; 2: 136).

Sulla base degli studi precedenti che elencavano il numero annuale delle pubblicazioni coinvolgenti il microbiota dell'intestino umano, gli Autori hanno scoperto che nel 2011 rispetto al 2005 ricorreva più di quattro volte il numero delle citazioni con riferimento al microbiota dell'intestino umano. Inoltre, nel 2011 vi erano tanti articoli pubblicati che indagavano sul microbiota intestinale umano quanti durante i dieci anni tra il 1993 e il 2002.
Gli Autori, comunque, concludevano che i fattori che influenzavano la composizione del microbiota intestinale e la sua relazione con i padroni di casa erano, comunque, di notevole complessità. Peraltro, entrambi i fattori fisiologici interni ed esterni all’ospite che condizionavano il microbiota intestinale erano spesso instabili nel tempo. Pertanto, nonostante il contributo delle correnti tecnologie, il repertorio di questo ecosistema rimaneva ancora incompleto.
Il microbioma intestinale dell’uomo alle varie età
La variazione genetica tra le diverse popolazioni umane è generalmente giustificata dalle differenze nelle frequenze alleliche dei geni condivisi dall’Homo sapiens. Un'altra fonte di diversità genetica e metabolica risiede, però, nelle differenze rappresentative dei milioni di geni e nella miriade di funzioni geniche della comunità microbica all'interno dell’intestino.
Come già accennato, l’insieme microbico in contatto con il corpo è vasto e diversificato, comprendendo organismi dieci volte il totale delle cellule e 100 volte la dimensione totale del genoma umano. La maggior parte di questi microbi partecipa alle attività metaboliche che interagiscono con l'habitat in cui crescono. Esempi sono i processi come la biodegradazione, la fissazione dell'azoto, la fotosintesi ossigenica, la produzione dei nutrienti e l’attivazione dei sistemi immunitari dell'ospite. Ciò che ne risulta è che la struttura e funzione microbica sono spesso associate con una varietà di caratteristiche ambientali e fisiologiche e patologiche dell’ospite, come l’area geografica di residenza, la dieta, l’esercizio fisico, la malattia infiammatoria intestinale (IBD), l'obesità. Un interesse particolare riveste lo studio del microbioma intestinale umano nelle varie età.
Il tratto gastrointestinale infantile è colonizzato dai microrganismi in un processo complesso che inizia già durante il parto. Si pensa che dipenda sia da condizioni genetiche e sia dai microbi presenti nell'ambiente che ospita che il bambino. Per questo motivo il tipo di parto comporta una particolare condizione differenziale nella comunità microbica intestinale del neonato. Difatti, i nati da taglio cesareo presentano profili microbici differenti rispetto ai partoriti per via vaginale. I primi, difatti, sono inizialmente esposti ai batteri derivati dall'ambiente ospedaliero e dagli operatori sanitari. I secondi, invece, nei primi momenti di vita sono soggetti alla colonizzazione dei batteri fecali e vaginali materni. Si è anche dimostrato che dopo il parto cesareo la flora intestinale si caratterizza per un'assenza della specie dei bifidobatteri, ritenuti importanti per lo sviluppo postnatale del sistema immunitario. I nati da parto vaginale, invece, hanno mostrato una predominanza di queste specie. Peraltro, i bambini nati da parto cesareo generalmente tendono anche a mostrare un ritardo di accesso al latte materno, che ha una potente influenza sul microbiota dell'intestino. Per tutto il primo anno di vita la composizione del microbiota intestinale dei bambini può variare ampiamente e dipendere ancora in gran parte dai ceppi batterici delle madri e dei conviventi. A un anno di età sembra, invece, che si possa già riconoscere un profilo simile agli adulti, soprattutto quando è iniziata l’alimentazione con i cibi solidi.
Date le dinamiche del microbiota della prima infanzia, si è ipotizzato che i neonati e i bambini siano particolarmente sensibili alle sue alternanze con le associate conseguenze per la salute. È interessante notare che la genetica dell’ospite può svolgere un ruolo sulla sua costituzione. Difatti, gli specifici loci genetici sembrano influenzare la sua composizione. Sotto tale ottica, l’ipotesi della programmazione precoce nella vita propone che il metabolismo energetico del primo microbiota e la sua interazione con il sistema immunitario determinano il rischio delle malattie più tardi, eventualmente mediato dall'epigenetica. Peraltro, i primi microbi commensali sono importanti anche per la produzione delle cellule di un’equilibrata risposta immunitaria a stimoli antigenici più diretti da parte delle cellule T helper (Th1/Th2).
Il microbiota intestinale, una volta completamente sviluppato in età adulta, rimane abbastanza stabile nel corso dei mesi o degli anni.
La maggior parte dei microbi dell'intestino dovrebbe stanziarsi nel colon, mentre solo in relativa piccola parte nei settori intestinali superiori. Nel corso del tempo, con le variazioni anatomiche intestinali, di motilità e di secrezione dell’acido gastrico, i microbi possono migrare dal colon fino nell'intestino tenue, con conseguente SIBO (small intestinal bacterial overgrowth), sindrome più comune nelle persone anziane, anche se i rapporti di prevalenza variano ampiamente.
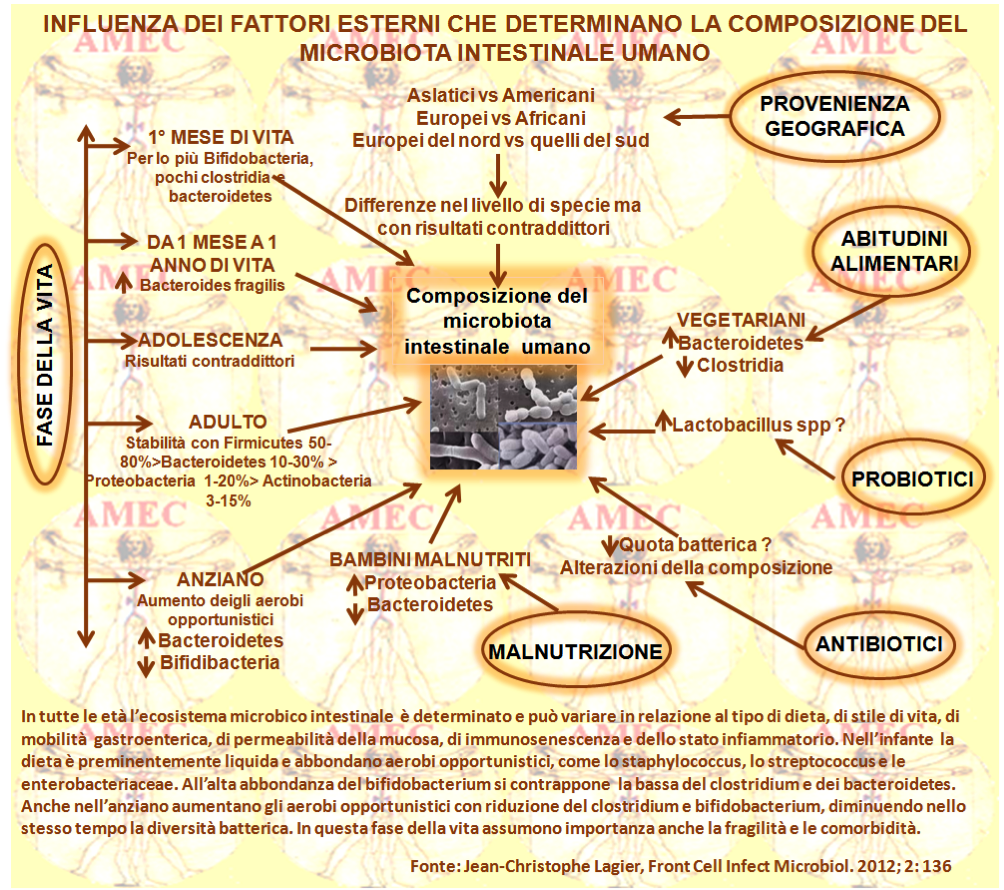
Il microbiota degli anziani mostra, in particolare, una maggiore variabilità inter-individuale rispetto a quello dei giovani adulti e la sua diversità e composizione sono strettamente collegate con i vari parametri di salute, tra cui le misure di fragilità, le comorbilità, lo stato nutrizionale, i marcatori dell’infiammazione. I dati supportano, peraltro, un’importante correlazione tra la dieta, il microbiota e lo stato di salute. Pur tuttavia, le riportate differenze legate all'età nella composizione della microflora intestinale includono l’aumento del numero totale degli anaerobi facoltativi e gli spostamenti delle specie dominanti all'interno dei diversi gruppi batterici, mentre il numero totale dei batteri anaerobici non sembra variare significativamente. L'invecchiamento, peraltro, condizionando di per sé una regressione delle funzioni fisiologiche, può senz’altro compromettere seriamente la composizione del microbiota intestinale. La ridotta motilità intestinale comporta già un transito più lento, compromettendo la regolare defecazione e portando alla costipazione. La riduzione consequenziale della ridotta escrezione batterica altera sfavorevolmente, di poi, i processi fermentativi dell'intestino e inevitabilmente influenza l'omeostasi dell'ecosistema batterico. Inoltre, l’immunosenescenza, come declino della funzionalità del sistema immunitario relativo all'età, interviene negativamente con uno stato infiammatorio cronico di basso grado. Viene, così, minato il fine e dinamico equilibrio omeostatico tra microbiota e sistema immunitario presente nell’intestino sano. Si determinano necessariamente anche i cambiamenti nella struttura e composizione del microbiota intestinale. Peraltro, a tutto ciò concorrono nelle persone di tarda età i cambiamenti del comportamento alimentare e dello stile di vita.
In tale ordine di fatti, Elena Biagi dell’University of Bologna, Italy e collaboratori hanno esplorato le differenze legate all'età della composizione dell'ecosistema intestinale, anche in stato d’infiammazione, utilizzando l’analisi HITChip e la PCR quantitativa dei geni 16S rRNA dei Batteri e dell’Archaea (PLoS One. 2010; 5(5): e10667).

In particolare, gli Autori hanno espanso la gamma delle solite popolazioni destinatarie degli studi comparativi, arruolando non solo i giovani adulti dai venti ai quaranta anni e anziani dai sessanta agli ottanta, ma anche i centenari, come rappresentanti di un gruppo di persone che avevano raggiunto i limiti estremi della vita umana. Tutto questo mirava all'ampliamento della visione delle differenze in ragione dell'età della flora intestinale degli esseri umani adulti.
Gli Autori osservavano che la composizione microbica e la diversità dell'ecosistema intestinale dei giovani adulti erano molto simili alle persone di settanta anni. Differivano, invece, significativamente da quella dei centenari. Dopo 100 anni di associazione simbiotica con l'ospite umano, il microbiota era caratterizzato da un riarrangiamento della popolazione dei Firmicutes e un arricchimento degli anaerobi facoltativi, in particolare pathobiont. La presenza di un tale compromesso nel microbiota dei centenari si associava a un aumentato stato infiammatorio, noto anche come inflammageing, definito da una serie d’indicatori nel sangue periferico.
Secondo gli Autori, tutto ciò poteva essere spiegato da una ristrutturazione del microbiota dei centenari con una marcata diminuzione del Faecalibacterium prauznitzii e affini, specie simbiotiche con segnalate proprietà anti-infiammatorie. Come batteri della lunga vita nei centenari s’identificavano specificamente con presenza più di dieci volte maggiore l’Eubacterium limosum e affini.
I risultati fornivano, quindi, la prova del fatto che il processo dell’invecchiamento influiva profondamente sulla struttura della flora intestinale umana, così come sulla sua omeostasi con il sistema immunitario dell'ospite. Pertanto, a causa del suo ruolo fondamentale sulla fisiologia e sullo stato di salute dell’ospite, le differenze nella composizione microbiotica dell'intestino legate all'età potevano essere correlate alla progressione delle malattie e alla fragilità degli anziani.
Sempre Elena Biagi e il suo gruppo di ricerca, considerando la rivisitazione degli esseri umani come metaorganismi per il loro stretto rapporto simbiotico con il microbiota intestinale, hanno osservato il processo dell’invecchiamento sotto una visione più olistica con le dinamiche d’interazione tra ambiente, microbiota intestinale e accoglienza (Age (Dordr). Feb 2012; 34(1): 247–267). In effetti, sull'ecosistema intestinale microbico influiscono inevitabilmente i cambiamenti fisiologici del tratto gastrointestinale legati all'età, i mutamenti dello stile di vita e del comportamento alimentare e la funzionalità del sistema immunitario dell'ospite. Gli Autori hanno passato in rassegna l'attuale conoscenza dei cambiamenti che si verificano nella flora intestinale degli anziani, soprattutto alla luce delle più recenti applicazioni delle moderne tecniche di caratterizzazione molecolare.
In particolare, secondo gli Autori il coinvolgimento ipotetico del microbiota legato all'età s’inseriva nei processi d’immunosenescenza e dell’infiammazione. La crescente evidenza dell'importanza dell’omeostasi del microbiota per la salute dell’uomo aveva portato, in effetti, alla considerazione delle applicazioni mediche / nutrizionali delle moderne conoscenze con lo sviluppo di preparati probiotici e prebiotici specifici per la popolazione di tarda età.
Zain Kassam dell’Harvard University, USA e Thomas S. Murray della Quinnipiac University, USA, data l'importanza emergente del microbioma rilevata nei neonati e nei bambini, hanno compiuto una recensione concentrando le attuali conoscenze sulla sua formazione ed evoluzione (Curr Pediatr Rep (2014) 2:93–101). Gli Autori mettevano anche in evidenza il nesso tra la disbiosi derivata dal microbiota patologicamente deviato con tre rappresentativi esempi di malattia pediatrica: quella infiammatoria intestinale, quelle atopiche e l’obesità. Suggerivano, quindi, la migliore strategia terapeutica.
Tanya Yatsunenko della Washington University in St. Louis e collaboratori, considerando che le comunità microbiche intestinali rappresentano una fonte di diversità genetica e metabolica per l’uomo, hanno esaminato in che modo differissero tra le popolazioni quando analizzate sotto il profilo dei lignaggi dei componenti microbici, delle funzioni metaboliche codificate, dello stadio dello sviluppo postnatale e delle condizioni ambientali (Nature. May 9, 2012; 486(7402): 222–227.). In effetti, secondo gli Autori il campionamento di una vasta popolazione di soggetti sani, che rappresentavano epoche e tradizioni culturali diverse, offriva l'opportunità di scoprire come il microbioma intestinale potesse evolvere lungo tutto l’arco di una vita, variare tra le diverse popolazioni e rispondere alle variazioni dello stile di vita.
Gli Autori caratterizzavano, così, specie batteriche presenti nei campioni fecali di 531 persone di amerindi sani dell’Amazonas del Venezuela, di residenti nelle comunità rurali del Malawi e di abitanti delle aree metropolitane degli Stati Uniti d'America. Caratterizzavano anche il contenuto genico di 110 campioni del loro microbioma. La coorte di studio comprendeva neonati, bambini, adolescenti e adulti, genitori e figli e anche mono e dizigoti. Le caratteristiche comuni della maturazione funzionale del microbioma intestinale erano individuate nel corso dei primi tre anni di vita in tutte e tre le popolazioni, comprese le modifiche associate all'età nella rappresentazione dei geni coinvolti nella biosintesi delle vitamine e nel metabolismo.
Si notavano differenze spiccicate negli assemblaggi di specie batteriche e nei repertori dei geni funzionali tra gli individui residenti negli USA, rispetto agli altri due paesi. Queste caratteristiche distintive erano evidenti nella prima infanzia, ma anche nell'età adulta. Inoltre, la somiglianza dei microbiomi fecali tra i membri della famiglia si estendeva attraverso le culture.
Questi risultati rilevavano, secondo gli Autori, la necessità di considerare il microbioma nella valutazione dello sviluppo umano, nelle esigenze nutrizionali, nelle variazioni fisiologiche e nell'impatto dell’occidentalizzazione.
Le funzioni del microbiota intestinale nell’uomo
Una delle funzioni principali della flora batterica intestinale è di limitare la crescita dei microrganismi potenzialmente patogeni, prevenendo la loro invasione e la loro realizzazione nell’ecosistema.

Il microbiota, infatti, compete per lo spazio e ha la capacità di secernere batteriocine, sostanze antimicrobiche che inibiscono la proliferazione degli altri batteri. In questo processo, mantiene una stabilità e metabolizza e sottrae prodotti non digeribili. In particolare, la fermentazione dei carboidrati non digeribili produce SCFA, acidi grassi a catena corta, come acetato, propionato e butirrato, che svolgono un ruolo importante nella modulazione dei diversi processi nel tratto gastrointestinale. Il butirrato è particolarmente importante come fonte di energia per l'epitelio del colon e l’acetato e il propionato sono utilizzati dal fegato come substrati per la lipogenesi e la gluconeogenesi. Inoltre, gli SCFA possono regolare l'espressione genica, sopprimere l'infiammazione e modulare la secrezione di GLP-1, migliorando quella dell’insulina ed esercitando, così, un effetto antidiabetico.
Inoltre, gli SCFA attivano il FFAR (free fatty acid receptor), che è un recettore del GPCR (G-protein-coupled receptor). L’acetato e il propionato sembrano attivare anche il FFAR2 e il butirrato il FFAR3, che svolgono un ruolo importante come sensori fisiologici per gli acidi grassi liberi derivati nel tratto gastrointestinale dal cibo e dai prodotti di digestione. Ancora, essi sono coinvolti nella secrezione dell’insulina e delle incretine ormonali e nella regolazione del sistema nervoso simpatico, nelle preferenze del gusto e nelle risposte infiammatorie causate dall’insulino-resistenza. Secondo alcuni Autori gli SCFA, attraverso la modulazione dei recettori specifici, sarebbero anche coinvolti nel controllo della pressione arteriosa. Bisogna, inoltre comprendere a tutto ciò il controllo degli elettroliti, come il calcio, il magnesio, il ferro, l’assorbimento dell’acqua, la proliferazione e la differenziazione cellulare, la secrezione degli ormoni e l'attivazione del sistema immunitario. Peraltro, per il loro ruolo gli SCFA sono utilizzati ugualmente dall'organismo come fonti di energia, anche se in piccola parte, per merito del fegato e dei muscoli, ma soprattutto dei colonociti, le cellule di rivestimento del colon.
Sono attribuite, altresì, al microbiota alcune funzioni metaboliche, quali la produzione di vitamine, come la K, la B12, la B5, la biotina, l’acido folico, e la sintesi di aminoacidi dall’ammoniaca o dall’urea.
Il microbiota umano gioca, in definitiva, un ruolo importante nelle attività biochimiche del corpo umano e, oltre a produrre vitamine e altri nutrienti essenziali, regola sotto molti aspetti l'immunità. Inoltre, attraverso i propri enzimi costitutivi, la flora microbica intestinale realizza la fermentazione dei nutrienti ingeriti e il metabolismo degli acidi biliari, portando alla loro conversione da primari in secondari. Questi ultimi agiscono, legandosi poi ai recettori cellulari implicati nella modulazione dei lipidi e nel metabolismo del glucosio, come molecole di segnalazione.
Di fatto, la composizione della dieta può avere un forte impatto sull'ambiente intestinale, compreso il tempo di transito, il pH e i substrati disponibili che i batteri possono utilizzare. Di conseguenza, le variazioni dell'assunzione dei tre principali macronutrienti (proteine, lipidi e carboidrati complessi digeribili e non) influenzano significativamente la composizione della flora intestinale.
I carboidrati non digeribili, in particolare, sono importanti fonti di energia per diversi membri del microbiota del colon.
In definitiva, ormai è noto che il microbiota intestinale ha un ruolo rilevante per la salute, entrando in relazione con le malattie gastrointestinali, ma anche extradigestive. Ripristinare la sua presenza fisiologica costituisce, quindi, un obiettivo clinico fondamentale nel trattamento di numerose malattie, tenuto conto che per la razza umana la sua modulazione rappresenta, di fatto, un dato innato antico. Importante, pertanto, è il riconoscimento dei fattori che influenzano la stabilità e la complessità del microbioma intestinale nello stato di salute e di malattia. Difatti, le caratteristiche proprie, quali la sua stabilità, la resilienza e la complessità, sono influenzate nel tempo sin dall'infanzia fino all'età adulta e avanzata. Come prima accennato, nell’intestino sano queste caratteristiche contribuiscono a importanti processi fisiologici, quali la protezione contro gli agenti patogeni, la formazione del sistema immunitario e la digestione del cibo per la fornitura di energia e nutrienti, tra cui le vitamine e gli SCFA. Peraltro, durante tutto il suo sviluppo e la sua maturità intervengono molti fattori per influenzare il microbioma, tra cui la genetica, la dieta e i farmaci. Da notare, comunque, che alcuni di questi fattori possono introdurre perturbazioni che investono la sua complessità e stabilità, rappresentando, quindi, potenziali agenti di disbiosi microbica.

Un microbioma in squilibrio dimostra, per esempio, un aumento dei batteri gram-negativi legati a uno stress ossidativo, all’infiammazione e alla produzione dei metaboliti nell’ambiente.
In ragione di quanto riportato, il commensale microbiota intestinale umano è diventato il focus d’interessi convergenti di diverse discipline, soprattutto in ragione del suo contributo durante tutto l’arco della vita alla definizione dello stato di salute e del rischio di malattia. Peraltro, si sono dimostrati collegamenti tra il cambiamento della sua composizione con quelli del comportamento e dello stile di vita. Molti degli elementi della vita moderna, in particolare dei primi anni di vita, possono, difatti, influenzare la sua composizione per alterazioni che alle varie età possono conferire il rischio di malattia.
Evoluzione del microbiota intestinale
I batteri hanno costituito certamente la prima forma di vita organizzata sul nostro pianeta e, come testimoniato dai reperti fossili, si deve alla loro evoluzione la caratteristica della vita moderna con la formazione fin da 3,25 miliardi anni delle comunità spazialmente organizzate. Oggi la vita microbica è presente sotto una grande diversità e varietà in diverse comunità in tutta la biosfera. Di certo interesse è lo studio delle caratteristiche ambientali, come la biogeografia, la salinità o il potenziale ossido riduttivo, che influenzano gli effetti importanti dell'organizzazione della diversità microbica. Per quanto riguarda la medicina, questi studi sono ora estesi alle comunità microbiche che popolano un habitat onnipresente sulle superfici del corpo dell’uomo.
Gli eucarioti multicellulari esistono, quindi, da almeno un quarto della storia della Terra, pari a 1,2 miliardi anni. Così che, si può considerare già una lunga storia d’interazione tra le forme di vita multicellulari e le comunità microbiche. In effetti, l'eredità di antiche associazioni tra l’ospite e le comunità microbiche epibionti è evidente negli effetti ancor oggi presenti con cui il microbiota intestinale influenza la biologia dell’ospite e che vanno dalla struttura e dalle funzioni dell'intestino e del sistema immunitario innato e adattativo, sino al metabolismo energetico dell’ospite. Le risposte dell’ospite alla colonizzazione microbica si sono, peraltro, conservate durante l’evoluzione come alcuni dei fondamenti del nostro genoma.
Ruth E. Ley della Washington University School of Medicine e collaboratori nella loro recensione hanno analizzato la flora intestinale umana nel contesto di molti altri diversi microbiota, da quella dei parenti stretti, i primati, a quella dei mammiferi più lontanamente legati, ad altri metazoi e infine alla vita libera delle comunità microbiche (Nat Rev Microbiol. Oct 2008; 6(10): 776–788). Gli Autori hanno usato le sequenze del gene 16S rRNA per il confronto degli assemblaggi batterici associati con gli esseri umani, con gli altri mammiferi, con gli altri metazoi e con le comunità microbiche a vita libera che abbracciavano una vasta gamma di condizioni ambientali. La composizione del microbiota intestinale dei vertebrati era influenzata dalla dieta, dalla morfologia e dalla filogenesi dell’ospite. In questo senso la comunità batterica dell'intestino umano era tipica di un primate onnivoro. Tuttavia, una visione più ampia rivelava che la flora intestinale dei vertebrati era fortemente differenziata da comunità di vita libera non connessi con l'habitat del corpo degli animali.
In conclusione, secondo gli Autori i fattori che influivano sulla flora intestinale delle specie animali erano determinati dall'impatto evolutivo della filogenesi, dalla morfologia del suo intestino e dalla sua dieta. In effetti, animali correlati in genere, come gli artiodattili, avevano lo stesso tipo di budello, di dieta e di comunità batterica intestinale.
Per loro conto, Marco Candela dell’University of Bologna, Italy e collaboratori hanno voluto confrontare la diversità filogenetica, l’abbondanza tassonomica relativa e il profilo degli SCFA (short-chain fatty-acid) del GM (gut microbioma) degli Hadza con quelli di sedici cittadini adulti di Bologna, rappresentanti di uno stile di vita occidentale (Nature Communications, Vol. 5, 3654, 15 April 2014). Gli Autori hanno poi raffrontato i dati con quelli in precedenza pubblicati su due diversi gruppi rurali africani del Burkina Faso (BF) e del Malawi per identificare le caratteristiche uniche del GM proprie dello stile di vita degli Hadza, cacciatori-raccoglitori, per capire come il microbiota umano si allineasse a uno stile di vita di foraggiamento in cui tutti gli antenati dell'uomo hanno partecipato prima della transizione neolitica.
Gli Autori dimostravano, così, che gli Hadza avevano maggiore ricchezza e biodiversità microbiche, rispetto ai controlli italiani. I confronti con i due gruppi africani, di allevamento rurale e che potevano ricollegarsi con uno stile di vita di foraggiamento, illustravano altre caratteristiche uniche per gli Hadza. Questi includevano l'assenza dei Bifidobacteri e le differenze nella composizione microbica tra i sessi, riflettenti probabilmente la ripartizione sessuale del lavoro. Inoltre, l'arricchimento in Prevotella, Treponema e Bacteroidetes non classificati, e anche una particolare disposizione di Clostridiales taxa, potevano aumentare la capacità di digestione degli Hadza e di estrazione del valore nutrizionale dagli alimenti vegetali ricchi in fibre.
Gli Hadza, una tribù di circa 200-300 individui, rappresentano, invero, un raro esempio di sussistenza umana dedita alla caccia e alla raccolta che persiste ancora nella regione dell'Africa orientale dove hanno vissuto i primi ominidi. Essi mantengono un’interfaccia diretta con l'ambiente naturale, da cui deriva il loro cibo, l’acqua e la complessità delle comunità microbiche. In questo quadro la struttura del GM rappresenta un adattamento allo stile di vita di foraggiamento.
In definitiva, secondo gli Autori la caratterizzazione del GM degli Hadza presentava una serie di caratteristiche uniche che suggerivano l'adattamento specifico per uno stile di vita dedito al foraggiamento, che comprendeva una grande proporzione di alimenti vegetali molto refrattari.
Modulazione intestinale del microbiota
Il corpo umano sulla sua superficie e al suo interno ospita in modo particolare miliardi di microbi. In effetti, i batteri buoni, con i quali l’uomo si è evoluto e ha stretto alleanze simbiotiche, sono presenti in proporzione di dieci a uno con le sue cellule e sono, quindi, in numero di trilioni. Il microbiota intestinale umano costituisce, così, una comunità molto densa di circa 10-100 trilioni di cellule batteriche e nello svolgere di millenni molte delle specie si sono probabilmente co-evolute con i padroni di casa. Anche se vi sono un’alta variabilità e una vasta diversità inter-individuale a livello di specie e ceppi, il microbiota umano sano è dominato dai batteri Bacterioidetes phyla e Firmicutes.
In definitiva, è stato definito un organo con funzioni essenziali per la nostra sopravvivenza e proprio come per il cuore, quando un agente ambientale ne altera la funzione, si può avere, come risultato, la malattia. Il trattamento antibiotico, ad esempio, di solito determina una diminuzione della diversità dei germi intestinali che, anche se rimangono stabili nella loro composizione, nei giorni o nelle settimane successive alla cura dimostrano una perdita di alcune specie a tempo indeterminato. In effetti, è questo il risultato degli studi sull'uomo e sugli animali sui cambiamenti a lungo termine delle popolazioni microbiche, anche con un solo trattamento antibiotico. Pur tuttavia, le conseguenze a lungo termine di queste condizioni per la salute sono ancora in gran parte sconosciute.
In rapporto a tali premesse, si è giunti a proporre per l’uomo che la stessa definizione di organismo dovrebbe essere aggiornata includendo questi microrganismi, senz’altro utili per la nostra stessa sopravvivenza. Dovremmo, difatti, essere definiti dei meta-organismi il che ci delfinerebbe una comunità di entità biologiche che interagiscono tra di loro, caratterizzata da un metagenoma di gran lunga più grande di quello che codificano i propri nostri cromosomi.
In un certo senso, quindi, ogni persona è costituita da più ecosistemi in cui il microbioma rappresenta una variegata collezione di specie microbiche che interagiscono tra loro e con le cellule dell’ospite. Contribuiscono, così, e sono sottoposte a ogni processo fisiologico normale e anormale che occorre nella vita quotidiana.
Come queste migliaia di miliardi di microbi influenzano lo stato di salute umana e quello di malattia è oggetto in quasi tutte le discipline mediche di numerose ricerche per un chiarimento sempre più convincente.
Sta di fatto che il normale rapporto simbiotico tra l’organismo umano e i microbi è in funzione dell'omeostasi tra le due parti, in ragione soprattutto della diversità dei germi e della loro stabilità. Di conseguenza, le interruzioni nell’omeostasi sono state associate a una serie di processi fisiologici e patologici, come nella malattia infiammatoria intestinale. Sono stati ricondotti a tale processo anche effetti indiretti, come il metabolismo dei farmaci, la generazione di composti antitumorali e lo sviluppo dell’autoimmunità.
Come già accennato, la comunità microbica dell’apparato gastrointestinale rappresenta da qualche tempo un obiettivo interessante di ricerca. In effetti, la composizione della parete intestinale e la presenza dei fattori proinfiammatori sono state a lungo legate alle ulcere, alla malattia infiammatoria intestinale e a quella cronica del fegato. Peraltro, i microbi svolgono nell'intestino anche un ruolo chiave nel metabolismo energetico, per cui, quando la loro comunità si altera, ne può derivare la malattia. Tale dato è stato esplorato tipicamente nello sviluppo della NAFLD (non alcoholic fatty liver disease), in cui l'assunzione del fruttosio ha dimostrato di aumentare la sintesi lipidica, compromettendo la sensibilità all'insulina e aumentando l’adiposità viscerale che predispone, appunto, all’epatopatia. È l’eccessiva disponibilità dello zucchero che comporta l’alterazione del microbioma intestinale, l’aumento della permeabilità della mucosa, l’infiammazione e infine il danno epatico. Al contrario, una dieta ed esercizio fisico adeguati e salutari si sono dimostrati, a tale riguardo, efficaci nell’influenzare il tasso metabolico e a contrastare la malattia.
Queste alterazioni del microbioma con una permeabilità intestinale alterata e con l'infiammazione cronica di basso grado sono state, peraltro, associate anche al diabete e all’obesità. D’altro canto, una dieta ricca di grassi altera anch’essa il microbiota, portando a un aumentato assorbimento di calorie. Inoltre, la riduzione della funzione della barriera intestinale può fornire più facile penetrazione ai microbi, avviando una cascata di risposte immunitarie e uno stato d’infiammazione cronica. È noto, in effetti, che la combinazione di una deregolazione del metabolismo e dell'infiammazione favorisce l'obesità e disturbi metabolici correlati.
Catherine A. Lozupone della Washington University in St. Louis, USA e collaboratori, considerando che una visualizzazione del microbiota da un punto di vista ecologico avrebbe potuto fornire un'idea di come promuovere la salute, hanno prodotto una recensione in cui hanno riassunto i progressi compiuti per la caratterizzazione della diversità e della funzione delle comunità microbiche dell'intestino umano sano, descrivendo anche il modo con cui questo ecosistema può alterarsi e discutendo le prospettive per il risanamento di un ecosistema degradato (Nature, Vol. 489, p. 220–230, 13 September 2012). In effetti, il microbiota intestinale è molto diverso da un individuo all’altro, ma anche nel tempo nella stessa persona. Ciò accade, soprattutto, durante la malattia e il primo sviluppo. La visualizzazione del microbiota da un punto di vista ecologico potrebbe, quindi, fornire un'idea di come promuovere la salute, avendo, come obiettivo nei trattamenti clinici, questa comunità microbica. Le perturbazioni del normale equilibrio tra la flora intestinale e l'ospite si rinvengono, in effetti, associate con l’obesità, con la malnutrizione, con la malattia infiammatoria intestinale (IBD), con diversi disordini neurologici e con il cancro.
Pertanto, riuscire a capire come il microbiota intestinale colpisce la salute e come interviene negli stati di malattia, richiede un approccio ecologico che deve considerare la comunità microbica nel suo insieme.
Microbioma intestinale ed esercizio fisico
Il microbiota è da qualche tempo al centro dell’interesse degli studi che hanno potuto dimostrare il suo ruolo in diverse malattie, potendo rappresentare sia un rischio sia un fattore protettivo riguardo a vari disordini dell’organismo come quelli immunoallergici e metabolici. In tal modo, si è andata evidenziando una rete di segnalazione tra il microbiota, l’immunità e il metabolismo dell'ospite. Anche i disturbi legati all'obesità sono stati collegati alle alterazioni della flora batterica e su questa scia d’intenzioni scientifiche l’esercizio fisico e lo stile di vita sedentario hanno pure dimostrato di poterlo modificare, lasciando, quindi, presupporre che gli atleti dovrebbero avere una flora batterica più diversificata rispetto alle loro controparti sedentarie.
A tal proposito, Siobhan F Clarke dell’University College Cork, Ireland e collaboratori, considerando che molti elementi del moderno stile di vita influenzano il microbiota intestinale, hanno voluto esplorare l’impatto dell’esercizio fisico e della dieta su di esso (Gut 2014. doi: 10.1136/gutjnl-2013-306541). Poiché gli estremi dell’esercizio accompagnano spesso quelli della dieta, gli Autori hanno affrontato il problema studiando atleti professionisti provenienti da un sindacato internazionale di squadra di rugby. Hanno, quindi, incluso nello studio due gruppi per controllare le dimensioni dell’attività fisica, dell’età e del sesso. L’analisi composizionale del microbiota era effettuata tramite il gene 16S rRNA, amplificato e sequenziato mediante PCR. Ogni partecipante completava un questionario di frequenza alimentare dettagliato con una lista nell'arco delle ultime quattro settimane di 187 prodotti alimentari.
Come previsto, i quaranta atleti e i quarantasei controlli maschi sani differivano significativamente rispetto alla creatinchinasi plasmatica, un indicatore del danno muscolare per esercizio fisico estremo. Nonostante questo dato, negli atleti i markers infiammatori e metabolici erano più bassi di quelli del gruppo di controllo. Per un verso ancora più importante, gli atleti avevano, specie in confronto agli uomini con alto indice di massa corporea, la presenza di una maggiore varietà di microrganismi intestinali con ventidue phyla distinti che, a sua volta, correlava positivamente con il consumo delle proteine e con la creatinchinasi.
In conclusione, i risultati dimostravano un impatto positivo dell’esercizio sulla diversità del microbiota intestinale, ma indicavano anche che il rapporto era complesso e correlato a diete estreme. Una ridotta variabilità del microbiota, in effetti, era collegata all’obesità e ad altri problemi di salute, mentre la maggiore biodiversità sembrava correlata a un profilo metabolico favorevole e a un sistema immunitario più efficiente.
Intestino e risposta immunitaria per il riconoscimento del self
In questo periodo, è divenuto chiaro che l'induzione e la regolazione del sistema immunitario dipendono dal microbiota. Diversi studi suggeriscono che la capacità dei leucociti di migrare verso il punto focale dell’infiammazione per distruggere gli agenti microbici patogeni potrebbe anche essere influenzato dagli SCFA. Tutto ciò in ragione del possibile ruolo rivestito dagli acidi grassi a catena corta nella regolazione della funzione leucocitaria mediante le citochine TNF-α, IL-2, IL-6 e IL-10, e nella produzione delle chemochine eicosanoidi.
In un contesto più ampio, gli enterociti svolgono un ruolo importante nella logistica del sistema immunitario. In effetti, la loro posizione in contatto con il lume intestinale è fondamentale per il riconoscimento iniziale delle molecole estranee e per la produzione dei segnali trasmessi alle cellule immunocompetenti. Pur tuttavia, la partecipazione degli enterociti al meccanismo di difesa non si limita solo a quella innata. Essi possono agire come cellule presentanti l'antigene, inducendo, quindi, una risposta immunitaria acquisita, mediata dai linfociti T. Una volta attivata dalle cellule presentanti l'antigene, l'espansione delle cellule T clonali risulta in Th-cellule, linfociti helper di diversi fenotipi quali i Th1, i Th2, o cellule T regolatorie. Queste ultime giocano un ruolo chiave nella tolleranza immunitaria perché secernono citochine regolatorie, anti-infiammatorie, come IL-10 e TGF-β, come risposta ad antigeni che sono riconosciuti non patogeni. Questo meccanismo spiega l’immunotolleranza in caso di esposizione a un carico antigenico innocuo, come ad esempio agli alimenti. D'altra parte, difetti nell’attività di queste cellule possono favorire lo sviluppo di malattie dovute alla disregolazione immunitaria.
Peraltro, c'è una crescente evidenza che la genetica dei mammiferi possa influenzare e interagire con la flora intestinale.
Come riportato da Medscape. Apr 03, 2013 il microbioma apre le porte a nuove soluzioni terapeutiche.
George Weinstock della Washington University in St. Louis, Missouri ha discusso nella riunione di Medicina Genomica VI a La Jolla, California come in un prossimo futuro la genomica potrà cambiare, con una tecnologia più profondamente precisa, la diagnosi e la gestione delle malattie infettive. Si dovrebbe arrivare a essere in grado di affrontare i problemi della salute da un punto di vista del microbioma con un approccio molto più desiderabile nei termini di precisione e di essere in grado, per esempio, di riservare un trattamento antibiotico per le situazioni che non possono essere risolte facilmente.
In definitiva, la comunità batterica residente nel lume intestinale dei mammiferi si è evoluta per prosperare in questo microambiente. Per conservare questa nicchia, i batteri commensali agiscono con l'ospite per impedire la colonizzazione dei patogeni invasivi che inducono l'infiammazione e sconvolgono questo rapporto. Così, è reciprocamente vantaggioso per i batteri commensali e per l’ospite inibire la capacità di un agente patogeno e impedire un'infezione. Il microbiota esprime, quindi, i fattori che sostengono la sua colonizzazione, massimizza l'assorbimento dei nutrienti e produce i metaboliti che conferiscono un vantaggio di sopravvivenza, rispetto ai patogeni. Inoltre, stimola le difese immunitarie dell'ospite e l’auto espressione dei fattori anti-microbici. Questi meccanismi conservano in combinazione la nicchia per i batteri commensali e assistono l'ospite nel prevenire le infezioni.
Barbosa T e Rescigno M dell’European Institute of Oncology, Milan – Italy, hanno ampiamente discusso il ruolo riconosciuto negli ultimi anni all'intestino come importante frontiera del corpo, non solo nel regolare selettivamente i nutrienti, ma anche nel modulare attivamente la risposta immunitaria, educando l’organismo al riconoscimento del self (Wiley Interdiscip Rev Syst Biol Med. 2010 Jan-Feb;2(1):80-97). Nella loro recensione gli Autori hanno raccolto le conoscenze dello stato dell’arte su come ospite e il microbiota intestinale interagiscono per promuovere l'omeostasi. Hanno anche cercato di fornire testimonianze sul malfunzionamento dei meccanismi descritti nella malattia infiammatoria intestinale umana. In effetti, la nozione stessa del self ha subito un drastico cambiamento con il riconoscimento che il nostro sé comprende anche quella pletora di specie microbiche che partecipano attivamente all’omeostasi del nostro corpo. Il sistema immunitario si adatta continuamente al microbiota in un ciclico, dinamico colloquio trasversale in cui le cellule epiteliali intestinali svolgono un ruolo importante nell’istruire le risposte non infiammatorie per un controllo dello stato stazionario della crescita batterica, o innescando meccanismi infiammatori che possono eliminare dall'intestino gli invasori dannosi. Il sistema è complesso e solido nel senso che molti giocatori, con ruoli parzialmente sovrapposti, agiscono tutti insieme per mantenere l'integrità della barriera mucosale intestinale. Il fallimento di questi meccanismi coinvolge inneschi genetici e ambientali e conduce alla malattia infiammatoria intestinale.
Il particolare ruolo dell’Helicobacter pylori
Al momento i fattori di rischio più comuni per il processo di aterosclerosi e che causano le malattie coronariche (CHD) includono principalmente il diabete, la dislipidemia, l’ipertensione e il fumo. Pur tuttavia, il ruolo di un processo infiammatorio attivo nella patogenesi dell'aterosclerosi è in crescita di proposizione presentando, peraltro, molte somiglianze e una coesistenza con la malattia. Sta di fatto che già da diversi anni i monociti e i macrofagi sono stati riconosciuti come i componenti delle placche ateromatose. Il rischio degli eventi cardiovascolari è stato anche associato all’aumento dei livelli delle proteine della fase acuta, come il fibrinogeno, la proteina C-reattiva (CRP) e le citochine proinfiammatorie. Pertanto, l'infiammazione cronica è ormai considerata come un fattore di rischio per la CHD e per le lesioni vascolari. L’infiammazione e la trombosi sono considerate cause dell’aterosclerosi, ma lo stimolo che genera la risposta infiammatoria è rimasto ancora poco chiaro.
L’HP (Helicobacter pylori) determina la più comune infezione in tutto il mondo e in particolare nei paesi in via di sviluppo. È stato anche riconosciuto come un fattore eziologico per lo sviluppo dell’ulcera peptica e del cancro gastrico ed è stato segnalato in associazione con molte manifestazioni supplementari, quali le malattie ematologiche, come la porpora trombocitopenica idiopatica (ITP), la carenza di ferro; i disturbi neurologici, come l'ictus e il Parkinson e il morbo di Alzheimer; l’obesità e i disturbi della pelle. Tra questi, l’ITP e la carenza di ferro hanno la migliore evidenza di alta qualità per il miglioramento dimostrato dopo l‘eradicazione del germe.
Pur tuttavia, l’Helicobacter pylori, che vive nell'interfaccia tra le superfici delle cellule epiteliali gastriche, forse rappresenta il classico esempio di come l'igiene abbia modificato il microbiota. Pur isolato nel 1980 e denominato Campylobacter pylori, oggi si ritiene che questo microbo sia presente nella maggior parte delle persone da millenni. In questo periodo, però, la maggiore igiene e il diffuso uso di antibiotici hanno decimato le popolazioni di questo germe, una volta ubiquitario. È stato osservato che nei paesi sviluppati le nuove generazioni stanno crescendo senza l’antico commensale H. pylori per orchestrare i loro ormoni gastrici. Peraltro, pur avendo questo microbo dimostrato di contribuire alla formazione dell’adenocarcinoma gastrico e del linfoma, ma anche delle ulcere, alcuni dati hanno confermato la sua associazione con un rischio significativamente ridotto di adenocarcinoma dell'esofago inferiore. Si è anche ipotizzato che l’H. pylori possa modulare lo stato immunologico, endocrino e le funzioni fisiologiche dello stomaco e che il calo d'incidenza dell’infezione nei paesi sviluppati possa contribuire proprio alla crescente incidenza dell’adenocarcinoma esofageo.
Franceschi F della Catholic University of Sacred Heart, Rome, Italy e collaboratori, considerando sconosciuto il ruolo dell’antigene CagA sull’instabilità coronarica, hanno eseguito uno studio clinico-patologico e una meta-analisi nel tentativo di gettare nuova luce sull’argomento (Atherosclerosis. 2009 Feb;202(2):535-42). La CagA (Cytotoxin-associated gene-A) viene, com’è noto, espressa da alcuni ceppi virulenti di H. pylori (Helicobacter pylori). Gli Autori hanno, così, arruolato trentotto pazienti con angina instabile (UA), 25 con quella stabile (SA), 21 con arterie coronarie normali (NCA) e cinquanta volontari sani abbinati per età e sesso. In tutti i pazienti era valutata la sierologia per il CagA. Campioni di placche aterosclerotiche erano ottenuti in tutti i pazienti attraverso aterectomia direzionale coronarica e per preparati per l’immunoistochimica utilizzando anticorpi monoclonali anti-CagA. La meta-analisi comprendeva nove studi che valutavano l'associazione tra la sieropositività per i ceppi CagA e gli eventi coronarici acuti.
Il titolo degli anticorpi anti-CagA era significativamente più alto nei pazienti con angina instabile (161 + / -90 RU / ml) rispetto a quelli con angina stabile (83 + / -59 RU / ml p <0.02), agli NCA (47.3 + / -29 RU / ml p <0.01) e ai controlli sani (73 + / -69 p <0,02). Gli anticorpi anti-CagA riconoscevano gli antigeni localizzati all'interno delle placche aterosclerotiche coronariche in tutti i campioni dei pazienti, sia stabili sia instabili. Nella meta-analisi, la sieropositività per il CagA era significativamente associata con l'insorgenza degli eventi coronarici acuti con un odds ratio (OR) di 1.34 (IC 95%, 1,15-1,58, p = 0,0003).
In conclusione, l'insieme di questi risultati suggeriva, secondo gli Autori, che in un sottogruppo di pazienti con angina instabile una risposta immunitaria intensa contro i ceppi dell’H. pylori CagA-positivi sarebbe potuta essere fondamentale per il precipitare dell'instabilità coronarica mediata dal mimetismo tra l'antigene CagA e una proteina contenuta nelle placche aterosclerotiche coronariche.
Jamshid Vafaeimanesh della Qom University of Medical Sciences, Qom, Iran e collaboratori hanno condotto uno studio prospettico per valutare l'associazione tra l’infezione HP e CAD in pazienti con elezione per l’angiografia coronarica, eseguita utilizzando il metodo Judkins (The Scientific World JournalVolume 2014 (2014), Article ID 516354, 6 pages). Il gruppo CAD positivo di sessantadue pazienti aveva una stenosi del lume > 50%, contrapposto a quello negativo di cinquantotto soggetti. Era verificata la presenza dell'anticorpo nel siero IgG HP. L’HP era più diffuso tra i pazienti CAD + e in ragione dell'aumento del numero di arterie coronarie con stenosi. La sieropositività HP aumentava in modo che il 76,3% dei pazienti con malattia multipla dei vasi e il 70% dei pazienti con malattia di un singolo vaso erano HP sieropositivi, contro il 50% del gruppo di controllo (












.png)





