Proprietà pleiotropica della metformina (glucophage)
La metformina, commercializzata per il trattamento del diabete di tipo 2 come glucophage per più di mezzo secolo, ha dimostrato di contrastare efficacemente molti dei sottostanti fattori che determinano la manifestazione di questa insidiosa malattia. Essa, peraltro, produce anche utili vantaggi collaterali che possono proteggere contro le complicazioni letali del diabete di tipo II senza indurre i gravi effetti collaterali frequentemente incontrati con altri farmaci.
In effetti, il farmaco antidiabetico ideale dovrebbe poter aumentare la sensibilità cellulare all'insulina, inibire l’assorbimento intestinale degli zuccheri in eccedenza, ridurre la produzione eccessiva epatica del glucosio, favorire la perdita del peso corporeo e ridurre i fattori di rischio cardiovascolare.
La metformina è il farmaco che fa tutto questo e molto altro.
Essa aumenta il numero dei recettori muscolari dell’insulina e degli adipociti e implementa l'attrazione per il recettore. Non aumenta la secrezione dell’insulina ma ne aumenta solo la sensibilità. Per questo motivo la metformina non può essere causa d’ipoglicemia. La sua azione complessivamente riduce i livelli dell’insulina, aumenta la sensibilità dei tessuti periferici ai suoi effetti, ne rinvigorisce la risposta e ripristina i suoi stessi livelli fisiologici e quelli del glucosio. In questo modo si può ottenere una perdita di peso e certamente una diminuzione del contenuto del grasso corporeo totale.

Tutte queste attività hanno in definitiva un potenziale effetto nel contrastare un certo numero di effetti nocivi associati agli elevati livelli dell’insulina nel sangue. Essi, com’è noto, corrispondono a un incremento delle infezioni, alla dislipidemia, all’ipertensione, all’aterosclerosi precoce, all'obesità e alle complicanze microvascolari, come la retinopatia, la nefropatia, la neuropatia. Problematiche che alla fine dei conti evolvono nelle malattie cardiovascolari.
In conclusione, la ricerca scientifica indica usi multipli della metformina ma con alcuni inconvenienti. Di conseguenza, numerosi benefici collaterali del farmaco, associati al trattamento e alla prevenzione del diabete, nonché altri disturbi, sembrano controbilanciare gli effetti collaterali limitati.
Peraltro, è ormai ampiamente accettato che l'effetto ipoglicemizzante della metformina si realizza principalmente attraverso una lieve e transitoria inibizione del complesso 1 della catena respiratoria mitocondriale con aumento del rapporto AMP/ATP e con attivazione dell’AMP chinasi. L’AMP chinasi attivata determina il passaggio delle cellule da uno stato anabolizzante a uno catabolico risultandone, da una parte, la conseguente inibizione del glucosio, dei lipidi e della sintesi proteica e dall’altra favorendo l'ossidazione degli acidi grassi e l'assorbimento del glucosio con associata perdita di peso e più bassi livelli dei trigliceridi. Questo percorso è stato confermato in diversi tipi di cellule coinvolte direttamente nel metabolismo nel dispendio energetico, come gli epatociti, le cellule muscolari scheletriche e quelle del pancreas Tuttavia, rimangono poco noti gli effetti della metformina sulle cellule vascolari che, in verità, sono quelle direttamente coinvolte nei processi dell’aterosclerosi. In effetti, mentre ci sono evidenze di studi clinici che dimostrano come la metformina migliori la reattività vascolare endoteliale e l’ipertensione, è insufficiente la comprensione dei meccanismi sottostanti.
Peraltro, l’attività del sistema angiotensinico svolge un ruolo fondamentale nella regolazione di molti stimoli e segnali che regolano la senescenza vascolare e, in definitiva, l’aterogenesi. L’Ang II è stata segnalata come fattore di accelerazione della senescenza delle VSMC (vascular smooth muscle cells). In effetti, diversi studi hanno dimostrato che l’Ang II, attraverso il legame con l’AT1R (Ang II type 1 receptor), è coinvolta nella progressione delle malattie cardiovascolari, comprese l’arteriosclerosi, l’ipertensione, l’ipertrofia cardiaca e lo scompenso di cuore. D’altro verso, l’interruzione o l'inibizione dell’AT1R per opera degli antagonisti del recettore Ang II promuovono la longevità. L’interruzione dell’AT1R diventa clinicamente ancora più utile se si tiene conto del fatto che le HFD (high-fat diet) sovraregolano l’AT1R.
In conformità a quanto premesso, si è dimostrato che la metformina diminuisce l'espressione dell’AT1R nell’aorta del topo, attenuando, quindi, la senescenza vascolare e l’aterosclerosi indotta da una HFD e suggerendo ancor più l'effetto protettivo del farmaco sul sistema vascolare.
Tutte queste evidenze portano a considerare che la metformina potrebbe essere utilizzata anche in prevenzione per attenuare il rischio cardiovascolare anche in assenza di diabete. Suggeriscono anche un suo effetto più ampio in altre malattie legate all'età.
Questi effetti aggiuntivi, quindi, di solito inattesi e correlati o non al meccanismo primario di azione della sostanza, conferiscono, di certo, alla metformina una proprietà pleiotropica con effetti che vanno di là della sua azione originaria ipoglicemizzante antidiabetica.
Alla luce di tutto ciò, la metformina deve essere considerata un farmaco appropriato di prima linea non solo per il controllo glicemico, ma anche in altre condizioni. Nel corso degli studi, lo spettro di azione del farmaco si è, quindi, ampliato includendo anche l'endotelio e le ovaie. Peraltro, anche se molte di queste azioni sono singolarmente di modesta portata, appaiono, però, nell’insieme sufficienti a conferire i benefici terapeutici non solo in campo cardiometabolico, ma anche negli aspetti riproduttivi in relazione con l’insulinoresistenza e gli stati proinfiammatori. Peraltro, nei cinquanta anni del suo uso clinico non sono stati riportati grandi rischi e gli eventi avversi gravi attribuibili a essa sono stati di bassa frequenza.
In particolare, Maciej Pruski della Medical University of Silesia, Katowice, Poland e collaboratori hanno studiato 128 pazienti con diabete di tipo 2 con dislipidemia mista, mantenuti durante lo studio con un intervento sullo stile di vita, randomizzati per due volte, inizialmente con metformina o con placebo e poi con fenofibrato micronizzato o placebo (Diabetes Care August 2009 vol. 32 no. 8 1421-1424).
Gli Autori hanno voluto, in tal modo, confrontare nei diabetici di tipo 2 con dislipidemia mista l'effetto a breve termine della metformina e del fenofibrato, somministrati da soli o in sequenza, sul metabolismo glucidico e lipidico, sui fattori di rischio cardiovascolare e sul rilascio di citochine da parte dei monociti.
Il fenofibrato, soprattutto se somministrato insieme alla metformina, si dimostrava superiore alla stessa metformina e allo stile di vita nell’evidenza degli effetti benefici sull’infiammazione sistemica, dell’emostasi e della funzione secretoria dei monociti nei pazienti diabetici di tipo 2 con dislipidemia mista.
Dal loro canto, Farshad Forouzandeh dell’University School of Medicine, Atlanta, GA e collaboratori hanno svolto uno studio nell’intento di valutare gli effetti migliorativi della metformina sull’aterosclerosi (J Am Heart Assoc. 2014; 3: e001202).
Gli Autori, usando ApoE _/_ C57BL/6J, scoprivano che la metformina attenuava l'aterosclerosi e la senescenza vascolare nei topi nutriti con una dieta ricca di grassi. Preveniva anche nell’aorta dei topi la sovraregolazione del recettore di tipo 1 dell’angiotensina II.
Pertanto, considerando i noti effetti deleteri dell'angiotensina II, mediati dal recettore di tipo 1, i benefici vascolari potevano essere mediati, almeno in parte, dalla sottoregolazione del recettore di tipo 1 dell'angiotensina II. Inoltre, gli Autori rilevavano che la metformina poteva indurre la perdita di peso senza incorrere nell’ipoglicemia. Per di più, ritrovavano che il farmaco aumentava la SOD (superossido dismutasi-1) ad azione antiossidante.
In conclusione, gli effetti pleiotropici della metformina dimostravano di migliorare l’aterosclerosi e la senescenza vascolare.
Metformina, diabete e malattie cardiovascolari
Nel programma di prevenzione del diabete la metformina ha guadagnato il ruolo di farmaco con eccezionale potenziale nella prevenzione di conversione dall’IGT al diabete di tipo 2. In altri termini, quindi, sembra essere un potenziale farmaco con multipli effetti terapeutici che vanno ben oltre il suo effetto di controllo della glicemia nel diabetico.
La malattia vascolare è, peraltro, una delle principali cause di morbilità e mortalità tra i pazienti con diabete che rappresentano ormai una percentuale consistente nell’ambito delle cardiovasculopatie, come la malattia coronarica, l’infarto miocardico acuto e l’ictus. Di certo, l'insulinoresistenza contribuisce notevolmente allo sviluppo di questi eventi, soprattutto nella sindrome metabolica e nel diabete di tipo 2. Ne consegue che il trattamento con un agente insulinosensibilizzante, come la metformina, può correggere nei pazienti con diabete mellito molte anomalie fisiopatologiche primarie, tra cui quelle del metabolismo lipidico, della funzione endoteliale e dell’iperattività piastrinica.
L’UKPDS (United Kingdom Prospective Diabetes Study Group) ha, invero, dimostrato che i pazienti con diabete di tipo 2 trattati con metformina avevano un rischio inferiore del 36% di tutte le cause di mortalità e minor rischio del 39% d’infarto miocardico, rispetto ai pazienti trattati in modo convenzionale (Lancet. 1998 Sep 12;352(9131):854-865).
Questa riduzione del rischio era particolarmente rilevante per la metformina rispetto all'insulina e al trattamento con la sulfonilurea, nonostante il simile controllo glicemico. La metformina sembra, peraltro, fornire protezione cardiovascolare oltre il controllo della glicemia, soprattutto perché la sua efficacia ipoglicemizzante si esplica con l’aumento dell'azione dell'insulina, soprattutto a livello del fegato e del muscolo scheletrico. Peraltro, con eccezione dell’insulina, generalmente considerata come il farmaco antidiabetico più efficace, diverse metanalisi hanno ormai confermato che la sua azione è almeno equivalente a quella delle altre comuni classi di antidiabetici.
Per altro canto, essendo il diabete di tipo 2 strettamente interconnesso con l’aumento della mortalità cardiovascolare, da qualche tempo è aumentato l’interesse di ridurre efficacemente la progressione dell'aterosclerosi abbassando i livelli di glucosio nel sangue. La metformina, a questo riguardo, ha dimostrato il successo di ridurre la morbilità e la mortalità cardiovascolare, esercitando in forma indipendente dall’azione antidiabetica anche un effetto benefico sui lipidi. Pertanto, sta emergendo nei diabetici di tipo 2 come strumento utile per l'attenuazione dell’attività aterosclerotica e per la protezione della vascolarizzazione. Per l’appunto, ci sono ormai evidenze sugli effetti favorevoli della metformina sul rischio cardiovascolare associato al diabete e quelli, sul controllo glicemico e lipidico hanno mostrato una condizione di dose dipendenza.

Ancora, alcuni studi hanno documentato durante la terapia con la sostanza una riduzione della pressione arteriosa, sia sistolica e sia diastolica.
Nei riguardi dei lipidi, si è dimostrato un ridotto effetto del loro accumulo nei macrofagi poiché si reprime la trascrizione FABP4 mediata dal FOXO1. La metformina ha, quindi, un effetto protettivo contro l’accumulo dei lipidi nei macrofagi e può servire come agente terapeutico di prevenzione e per il trattamento dell’aterosclerosi nella sindrome metabolica. Inoltre, il farmaco ha dimostrato di ridurre l'accumulo dei lipidi negli adipociti e in modo significativo quello nei macrofagi indotto dall’acido palmitico. Oltre tutto, riducendo l’espressione del FABP4 (fatty acid-binding protein 4), coinvolto nell’accumulo dei lipidi indotto dall’acido palmitico, promuove ulteriormente l'espressione del CPT-1 (carnitine palmitoyltransferase I). La PCR, per suo conto, ha dimostrato che la metformina modula l'espressione del FABP4 a livello trascrizionale.
La metformina, insomma, diminuisce l’espressione del FABP4 promuovendo l’esclusione del FOXO1 nucleare e, in seguito, limitandone l’attività.
Si riduce in altri termini nei pazienti diabetici il loro alto rischio d’infarto miocardico. Il ruolo vaso protettivo è sostanzialmente autonomo e indipendente dalla sua azione ipoglicemizzante ed è stato attribuito ai suoi effetti pleiotropici. La sua azione benefica sui vasi è, difatti, riconducibile ai suoi effetti sui lipidi, sull’infiammazione, sull’emostasi, sulla funzione endoteliale e su quella piastrinica.
Song J della Shandong University, Jinan, Shandong, China e collaboratori, considerando la segnalazione dell’attività della metformina nel ridurre l'accumulo dei lipidi negli adipociti, hanno studiato questo effetto nei riguardi dei macrofagi studiandone i meccanismi coinvolti (Biochemical and Biophysical Research Communications.2010; 393 (1): 89-94).
Ciò anche in ragione del fatto che l'accumulo dei lipidi nei macrofagi contribuisce allo sviluppo dell’aterosclerosi e che le strategie per evitarlo possono, di certo, avere un potenziale terapeutico di prevenzione e per il trattamento anche delle complicanze cardiovascolari.
Gli Autori osservavano che la metformina riduceva significativamente l’accumulo intracellulare dei lipidi indotto dal PA (palmitic acid) nei macrofagi. Promuoveva l'espressione della CPT-1carnitina I (carnitine palmitoyltransferase I), mentre riduceva quella della FABP4 (acid-binding protein 4), coinvolta nell’accumulo dei lipidi indotto dal PA. La PCR quantitativa in tempo reale dimostrava che il farmaco regolava l'espressione del FABP4 a livello trascrizionale. S’identificava un fattore di trascrizione FOXO1, come regolatore positivo dell’espressione FABP4. L'inibizione dell'espressione FOXO1 con il FOXO1 siRNA riduceva notevolmente quella del FABP4 basale e quella indotta dal PA. La sovra espressione del FOXO1 grezzo e del FOXO1, costruttivamente attivo, aumentava significativamente l’espressione del FABP4, mentre il FOXO1 dominante negativo diminuiva drasticamente l’espressione del FABP4. La metformina riduceva l’espressione del FABP4, promuovendo l’esclusione nucleare del FOXO1 e inibendone consequenzialmente l'attività.
In conclusione, questi risultati nel loro insieme suggerivano agli Autori che la metformina riduceva l'accumulo dei lipidi nei macrofagi reprimendo la trascrizione FABP4, mediata dal FOXO1. In tal modo, la metformina poteva essere considerata con un ruolo protettivo contro l'accumulo dei lipidi nei macrofagi, servendo anche come agente terapeutico per la prevenzione e il trattamento dell’aterosclerosi nella sindrome metabolica.
Hong J della Shanghai Jiao Tong University School of Medicine, China e collaboratori hanno voluto confrontare con lo SPREAD-DIMCAD (Study on the Prognosis and Effect of Antidiabetic Drugs on Type 2 Diabetes
Mellitus with Coronary Artery Disease), studio clinico controllato con placebo, multicentrico, randomizzato, in doppio cieco, gli effetti a lungo termine della glipizide e della metformina sugli eventi cardiovascolari maggiori nei pazienti diabetici di tipo 2 che avevano una storia di malattia coronarica (Diabetes Care. 2013 May;36 (5):1304-11).
Ciò in considerazione che le due principali classi dei farmaci antidiabetici, le sulfoniluree e la metformina, potevano influire in modo differenziale sulle complicanze macrovascolari e sulla mortalità dei pazienti diabetici.
Gli Autori arruolavano, così, un totale di 304 pazienti diabetici di tipo 2 con CAD (coronary artery disease) di età media di 63,3 anni (range, 36-80), assegnati per tre anni in modo casuale a ricevere glipizide (30 mg/die) o metformina (1,5 g/die). Gli end point primari erano volti al composito di eventi cardiovascolari ricorrenti, tra cui la morte per qualsiasi causa anche cardiovascolare, l’infarto miocardico e l’ictus non fatale, o la rivascolarizzazione arteriosa.
Alla fine della somministrazione del farmaco in studio, entrambi i gruppi raggiungevano una significativa diminuzione del livello dell’emoglobina glicata (7,1% nel gruppo glipizide e 7,0% in quello metformina). Dopo un follow-up medio di cinque anni, novantuno partecipanti sviluppavano 103 endpoint primari. L’analisi ITT (intention-to-treat) mostrava un HR (hazard ratio) di 0.54 (IC 95%= 0,30-0,90; P = 0,026) per i compositi degli eventi cardiovascolari tra i pazienti che avevano ricevuto la metformina, rispetto alla glipizide. Gli end point secondari e gli eventi avversi non risultavano significativamente differenti tra i due gruppi.
In conclusione, la terapia per tre anni con metformina riduceva i maggiori eventi cardiovascolari sostanzialmente del 46% nel follow-up di cinque anni, rispetto a quella con glipizide. Pertanto, gli Autori affermavano che i loro risultati indicavano nei pazienti ad alto rischio un potenziale beneficio della terapia con metformina sugli esiti cardiovascolari.
Boyle P dell’International Prevention Research Institute, Lyon, France e collaboratori, annotando che l’efficacia degli agenti ipoglicemizzanti dipendeva da una serie di fattori, compreso il loro profilo di sicurezza, hanno intrapreso il progetto DIABAMON (Diabetes Adverse Event Monitor) per una valutazione sistematica della letteratura pubblicata sull'effetto e sugli eventi avversi gravi dei farmaci antidiabetici (American Diabetes Association, Scientific Sessions; June 23, 2013; Chicago, IL. Abstract 1405-P).
La metanalisi dimostrava tra i diabetici reclutati per studi clinici un tasso di mortalità per tutte le cause più basso dai 2.16 di SRR= (IC 95% (1.87, 2.48) del 1970, all’1.82 (1.69, 1.96) del 1980 e all’1.69 (1.57, 1.79) del 1990 per raggiungere l’1.89 (1.33, 1.87) nel 2000.
Vi era nei diabetici un aumento di due volte del rischio delle malattie cardiovascolari, ma nei Paesi ad alta risorsa economica il rischio di morire di molte forme di malattie cardiovascolari (CVD) era in diminuzione. Peraltro, il rischio della malattia coronarica (CHD) nei diabetici reclutati nel 1970 vs i pazienti senza questa malattia metabolica, (SRR = 2.27, (1.64, 3.16) era sceso progressivamente nel 1980 (SRR = 2.02, (1.78, 2.29), nel 1990 (SRR = 1.98, (1.78, 2.29) e nel 2000 (SRR = 1.58 (1.66, 2.37).
Gli Autori, quindi, consideravano che il rosiglitazone si fosse dimostrato associato a un aumento del rischio di CVD, compresa l’insufficienza cardiaca e l’infarto miocardico e il pioglitazone a una riduzione del rischio di morte, d’infarto miocardico e d’ictus (SRR = 0.82, (0,72, 0,94). Peraltro, in studi randomizzati la glargine si era dimostrata non in associazione con un aumento del rischio di CVD, mentre una metanalisi di studi sulla metformina aveva indicato un ridotto rischio (SRR = 0,85 (0,77, 0,95).
Più in particolare, in ventinove studi la metformina si era associata con una riduzione del 10% del rischio degli eventi cardiovascolari, in sette del 10% del rischio d’insufficienza cardiaca e in nove del 12% del rischio d’infarto miocardico. Al contrario, il rosiglitazone si era associato in venticinque studi a un aumento del 21% del rischio degli eventi cardiovascolari, in tredici del 27% del rischio d’insufficienza cardiaca e in ventuno del 17% del rischio d’infarto miocardico.
Nei riguardi del pioglitazone la metanalisi offriva risultati meno chiari. Si evidenziavano, comunque, una riduzione del 9% del rischio degli eventi cardiovascolari e una riduzione del 10% di quello d’infarto miocardico. Nessun rapporto, invece, si otteneva con l’insufficienza cardiaca.
Gli Autori concludevano, così, che il progetto DIABAMON s’impegnava a eseguire un monitoraggio sistematico delle CVD e dei farmaci ipoglicemizzanti con rigorosi meta-analisi e aggiornamenti continui tramite i dati derivati da una varietà di fonti. Tutto ciò si derivava anche dai progressi nel corso degli ultimi quaranta anni sulla riduzione del rischio di morte e delle gravi malattie cardiovascolari nel diabete. In effetti, prendevano atto dei miglioramenti di prevenzione con l'uso delle statine sulle malattie cardiovascolari nel corso dei decenni precedenti, del migliore controllo della pressione arteriosa e dell’efficacia della lotta contro il fumo di tabacco, nonché della migliore gestione del diabete.
David Preiss della BHF Glasgow Cardiovascular Research Centre UK e collaboratori hanno valutato gli effetti cardiovascolari della metformina in individui senza diabete di tipo 2 in uno studio in doppio cieco, controllato con placebo (Lancet Diabetes Endocrinol 2014; 2: 116–24).
Tutto ciò nell’ipotesi che la metformina potesse ridurre il rischio cardiovascolare nei pazienti con diabete di tipo 2, indipendentemente dalla sua proprietà di abbassare la concentrazione del glucosio nel sangue.
Gli Autori arruolavano, così, pazienti senza diabete di tipo 2, ma con ampia circonferenza della vita, che assumevano statine e che avevano sofferto della malattia coronarica. I partecipanti erano randomizzati con il computer (1: 1) a metformina (850 mg due volte il giorno), o a placebo in blocchi di dimensioni di quattro.
L'endpoint primario era la progressione oltre diciotto mesi del cIMT (distal carotid intima-media thickness). Gli endpoint secondari erano i cambiamenti nel punteggio della placca carotidea in sei sedi, le misure della glicemia (l’HbA1c, il glucosio a digiuno, le concentrazioni dell'insulina, l’HOMA-IR [Homeostasis Model Assessment of Insulin Resistance]), le concentrazioni dei lipidi, l’hs-CRP (high-sensitivity C-reactive protein) e l’attivatore tissutale del plasminogeno.
Si selezionavano 173 pazienti, di cui ottantasei nel gruppo della metformina e ottantasette del placebo. L’età media era di sessantatré anni e al basale la media cIMT era 0·717 millimetri (SD 0 · 129), il punteggio medio di placca carotidea 2·43 (SD 1 · 55).
La progressione della cIMT non differiva significativamente tra i gruppi (andamento della differenza 0·007 millimetri l'anno, IC 95%= -0·006-0·020; p = 0·29). La variazione del punteggio delle placche carotide non differiva significativamente tra i gruppi (0·01 l'anno, IC 95% -0·23-0·26; p = 0·92). I pazienti trattati con metformina dimostravano minore HbA1c, insulina, HOMA-IR e plasminogeno tessutale, rispetto a quelli trattati con placebo. Non c'erano, però, differenze significative di aumento del colesterolo totale, delle HDL-colesterolo, delle non-HDL-colesterolo, dei trigliceridi, dell’hs-CRP, o della glicemia a digiuno.
Occorrevano 138 eventi avversi in sessantaquattro pazienti del gruppo metformina, rispetto ai 120 in sessanta pazienti del gruppo placebo.
La diarrea, la nausea o il vomito erano più comuni nel gruppo metformina, rispetto a quello placebo (28 vs 5).
In conclusione, la metformina nei pazienti non-diabetici con alto rischio cardiovascolare e in cura con statine non mostrava effetto sulla cIMT e poco o nessuno sui diversi marker surrogati di malattia cardiovascolare.
Berkowitz SA dell’Harvard Medical School, Boston e collaboratori, per determinare l'effetto iniziale di classe degli agenti ipoglicemizzanti orali sulla conseguente necessità di intensificare il trattamento e su quattro eventi clinici avversi a breve termine, hanno condotto uno studio retrospettivo di coorte su pazienti con prescrizione di un farmaco ipoglicemizzante orale a partire dal luglio 2009 sino al giugno 2013 (JAMA Intern Med. 2014 Dec;174 (12):1955-62).
Gli Autori notavano, che, anche se molte classi di farmaci ipoglicemizzanti orali erano state approvate per l'uso, esistevano poche evidenze sulla loro efficacia comparativa per guidare la selezione iniziale della terapia del diabete mellito.
Erano, quindi, controllati 15.516 pazienti che avevano incontrato i criteri d’inclusione, di cui 8.964 (il 57,8%) iniziavano la terapia con metformina.
L'esito primario era il momento d’intensificazione del trattamento, definito come l'inizio di una diversa classe di farmaci ipoglicemizzanti orali.
Gli esiti secondari includevano il tempo di un evento cardiovascolare composito (malattia coronarica, insufficienza cardiaca congestizia, angina instabile, ictus ischemico, infarto miocardico acuto, o una procedura di rivascolarizzazione), l’insufficienza cardiaca congestizia da sola, una visita di pronto soccorso o un’ammissione in ospedale per ipoglicemia o qualsiasi altra emergenza correlata al diabete.
Nell’analisi non regolata l’uso dei farmaci diversi dalla metformina si associava significativamente a un aumento del rischio di aggiungere solo un secondo agente orale, solo l'insulina e un secondo agente o insulina (P <.001 per tutti). In un punteggio di propensione e nei modelli multivariati aggiustati dei rischi proporzionali di Cox l'inizio della terapia con sulfoniluree (hazard ratio [HR], 1,68; IC 95%= 1,57-1,79), con tiazolidinedioni (HR, 1,61; IC 95%= 1,43-1,80) e con DPP-IV (dipeptidyl peptidase-4 inhibitors) (HR, 1,62; IC 95%= 1,47-1,79) si associava a un’intensificazione accresciuta del rischio. I farmaci alternativi alla metformina non erano associati a un rischio ridotto d’ipoglicemia, di accessi al pronto soccorso, o di eventi cardiovascolari.
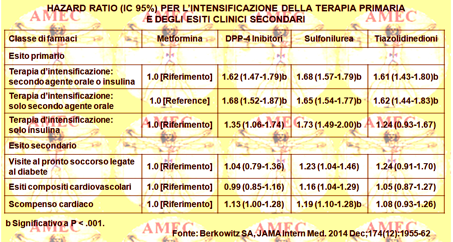
In conclusione, gli Autori affermavano che, nonostante le insistenze delle linee guida, solo il 57,8% dei diabetici iniziava il trattamento con metformina. Di fatto, l’uso della metformina come farmaco iniziale avrebbe fatto ottenere una consequenziale ridotta intensificazione del trattamento, senza differenze nei tassi d’ipoglicemia o di altri eventi clinici avversi. Questi risultati avevano, quindi, implicazioni significative per la qualità della vita dei malati e per i risparmi delle risorse sanitarie.
In effetti, rispetto al 25% dei pazienti con uso di metformina che avevano richiesto un secondo agente orale, il 37% di quelli con sulfonilurea, il 40% di quelli tiazolidinedione e il 36% di quelli con DPP4 erano incorsi in questa necessità. Rispetto a chi usava la metformina, il rischio per il trattamento d’intensificazione era, quindi, maggiore del 68% tra gli utenti della sulfanilurea, del 61% tra gli utenti tiazolidinedione e del 62% tra gli utenti del DPP4. Inoltre, rispetto alla metformina, l’uso della sulfonilurea si associava a un aumentato rischio di eventi cardiovascolari compositi, d’insufficienza cardiaca congestizia e d’ipoglicemia. Gli Autori, pertanto, dichiaravano che i loro risultati avevano, di certo, implicazioni significative per la qualità della vita dei pazienti e dei costi dei farmaci.
Komola Azimova del Texas Tech University Health Sciences Center e collaboratori hanno compiuto una ricerca bibliografica dall’Agosto 2013 sui disponibili profili di sicurezza cardiovascolare nei riguardi dei farmaci antidiabetici (The Ochsner Journal 14: 616–632, 2014).
Gli Autori ponevano l’accento sul fatto che nel diabete le malattie cardiovascolari erano la principale causa di morbilità e mortalità per cui era importante la scelta di un farmaco che non potesse aumentarne il rischio, ma piuttosto ridurlo. In effetti, dal 2008 la Food and Drug Administration raccomandava che i nuovi farmaci per il diabete di tipo 2 fossero sottoposti a studi clinici che potessero dimostrare la loro sicurezza cardiovascolare in aggiunta ai benefici sull’omeostasi glucidica. Peraltro, nel 2012 l'Agenzia europea per i medicinali emetteva una raccomandazione del tutto simile.
Nei riguardi della metformina gli Autori riportavano che era considerata un presidio di prima linea per il trattamento del diabete mellito di tipo 2 perché efficace nel ridurre la glicemia. Aveva, peraltro, una lunga storia di utilizzo, un effetto indifferente sul peso, era a basso costo, provocava un minimo effetto ipoglicemico e aveva il potenziale di ridurre gli eventi cardiovascolari. L’UKPDS (United Kingdom Prospective Diabetes Study), studio di una sottopopolazione che aveva incluso pazienti in sovrappeso con il diabete, aveva messo in luce che la metformina, quando avviata all'inizio della malattia, si associava a una significativa riduzione del 32% del rischio per qualsiasi esito correlato al diabete, come la morte improvvisa, l’infarto miocardico fatale o non, l’angina, l’insufficienza cardiaca, l’ictus e le amputazioni da gangrena. La riduzione era del 42% per la morte correlata al diabete, come decesso per infarto miocardico, per ictus, per malattia vascolare periferica e del 36% per tutte le cause di mortalità. La metformina aveva mostrato un effetto significativamente maggiore rispetto alla clorpropamide, alla glibenclamide o all’insulina su qualsiasi endpoint correlato al diabete, per tutte le cause di mortalità e per lo stroke.
Lo studio più piccolo, randomizzato, controllato con placebo con un periodo di follow-up di 4,3 anni di Kooy A del RA Hoogeveen, the Netherlands e collaboratori su 390 pazienti, trattati con insulina nelle cliniche ambulatoriali di tre ospedali, confermava che la metformina riduceva come endpoint secondario il rischio di malattia macrovascolare (Arch Intern Med. 2009 Mar 23;169 (6):616-25).
In tal caso la metformina cloridrato 850 mg, o il placebo per 1-3 volte il giorno erano aggiunti alla terapia insulinica. L'end point primario era un aggregato di morbilità e mortalità microvascolare e macrovascolare. Gli end point secondari erano la morbilità e la mortalità microvascolare e macrovascolare, come punteggi aggregati separati. Inoltre, erano analizzati gli effetti sull’emoglobina A (1c), sul fabbisogno d’insulina, sui livelli dei lipidi, sulla pressione arteriosa, sul peso e sull'indice di massa corporea.
Il trattamento con metformina impediva l’aumento del peso (incremento medio = -3,07 kg [gamma, -3,85 a -2,28]; P <.001), migliorava il controllo glicemico (riduzione della HbA dire (1c) livello, 0,4% punti percentuali [IC 95%= 0,55-0,25]; P <.001), nonostante l'obiettivo simile del controllo glicemico in entrambi i gruppi e il fabbisogno d’insulina ridotto (riduzione media, 19.63 IU / d [IC 95%= 24,91-14,36 IU / d]; P <.001). La metformina non era, peraltro, associata con un miglioramento dell'endpoint primario, ma con quello secondario dell’end point macrovascolare (hazard ratio, 0.61 (IC 95%= 0,40-0,94;. P = .02), in parte spiegato con la differenza del peso. Il numero necessario per il trattamento per prevenire un end point macrovascolare era 16,1 (IC 95%= 9,2-66,6).
In conclusione, la metformina, aggiunta all'insulina nei pazienti con DM2, migliorava il peso corporeo, il controllo glicemico e la richiesta d’insulina, ma non l'endpoint primario. Tuttavia, dopo un periodo di follow-up di 4,3 anni riduceva il rischio di malattia macrovascolare. Questi effetti benefici sostenevano la politica di continuare in tutti i pazienti con DM2, salvo controindicazioni, il trattamento con metformina dopo l'introduzione dell’insulina.
D’altro canto la metanalisi di Lamanna C del Careggi Teaching Hospital, Florence, Italy suggeriva che l'uso della metformina, in pazienti giovani e per periodi più lunghi, poteva correlare con una migliore riduzione dell’evento CV, rispetto al placebo o a nessuna terapia (Diabetes Obes Metab. 2011 Mar;13 (3):221-8).
Gli Autori, partendo in tal caso dalla premessa che alcuni studi avevano suggerito che la metformina avrebbe potuto ridurre il rischio cardiovascolare in misura superiore a quello determinato dalla riduzione del glucosio, hanno compiuto la loro meta-analisi per valutare gli effetti del farmaco sull’incidenza degli eventi cardiovascolari e della mortalità.
Hanno, quindi, eseguito una vasta ricerca della letteratura fino al 31 ottobre 2009, selezionando trentacinque studi clinici randomizzati con 7.171 e 11.301 partecipanti trattati rispettivamente con metformina e di confronto della durata uguale o superiore alle cinquantadue settimane. Una metanalisi di regressione era effettuata anche per identificare nei pazienti trattati con metformina i fattori associati alla morbilità e alla mortalità cardiovascolare.
Si dimostravano 451 e 775 eventi cardiovascolari (CV), rispettivamente. Nel complesso, la metformina non si associava a un danno significativo o a un vantaggio sugli eventi cardiovascolari (MH-OR 0,94 [0,82-1,07], p = 0,34). Un vantaggio significativo si osservava, invece, negli studi verso il placebo / nessuna terapia (MH-OR 0,79 [0,64-0,98], p = 0,031), ma non negli studi attivi di confronto (MH-OR 1.03 [0,72-1,77], p = 0,89). La metaregressione mostrava una correlazione significativa dell'effetto della metformina sugli eventi cardiovascolari con la durata di prova e con l'età minima e massima per l'inserimento. Ciò significava che il farmaco sembrava essere più vantaggioso sui pazienti più giovani con gli studi più lunghi. Era probabile che la monoterapia con metformina si associasse a un miglioramento della sopravvivenza (MH-OR: 0,801 [0,625-1,024], p = 0,076). Tuttavia, l'uso concomitante con le sulfaniluree si associava a una sopravvivenza ridotta (MH-OR: 1.432 [1,068-1,918], p = 0,016).
In conclusione, le evidenze disponibili sembravano escludere qualsiasi effetto nocivo complessivo della metformina sul rischio cardiovascolare, suggerendo un possibile beneficio rispetto al placebo / nessun trattamento. L'effetto negativo osservato della combinazione con le sulfoniluree meritava, peraltro, ulteriori indagini.
Mopelola A. Adeyemo del National Institutes of Health e collaboratori, sulla base delle capacità della metformina nel promuovere la perdita di peso, ritenuta almeno in parte attribuibile alla diminuzione dei consumi energetici, hanno studiato i suoi effetti sull’appetito e sull’assunzione di calorie nei bambini obesi iperinsulinemici (Diabetes Obes Metab. 2015 April; 17 (4): 363–370).
Gli Autori rilevavano che vi erano pochi dati riguardanti quest’aspetto del farmaco e, quindi, conducevano una ricerca di sei mesi, randomizzata, controllata con placebo in doppio cieco per valutare gli effetti della metformina 1000 mg due volte il giorno sul peso corporeo e sul bilancio energetico in 100 bambini obesi e iperinsulinemici di età dai sei ai dodici anni.
Rispetto al placebo, il trattamento con metformina suscitava, rispetto al basale, una significativa riduzione nel consumo di energia media aggiustata dopo il carico del prepasto (metformina: -104,7 ± 83,8 kcal vs placebo: + 144.2 ± 96,9; p = 0,034), indipendente dai cambiamenti nella composizione corporea. La metformina diminuiva significativamente il rating della fame (-1.5 ± 5.6 vs. + 18,6 ± 6,3; p = 0,013) e aumentava dopo il carico del prepasto il rating della ripienezza (+ 10,1 ± 6,2 vs -12.8 ± 7.0; p = 0.01).
In conclusione, i dati suggerivano che la diminuzione della percezione della fame con conseguente riduzione dell'assunzione del cibo risultava tra i meccanismi attraverso i quali il trattamento con metformina aveva effetto sul calo del peso corporeo nei bambini in sovrappeso con iperinsulinemia.
Tannaz Moin dell’University of California, Los Angeles, California e collaboratori hanno voluto analizzare la prescrizione della metformina per la prevenzione del diabete e le caratteristiche del paziente che potessero influenzarla (Ann Intern Med. 2015;162 (8):542-548).
Gli Autori hanno, così, effettuato uno studio di coorte retrospettivo su un periodo di tre anni sui piani di salute del più grande assicuratore privato nazionale.
Hanno, quindi, selezionato un campione nazionale di 17.352 adulti con prediabete in età lavorativa, assicurati per tre anni continui tra il 2010 e il 2012, misurando la percentuale d’iscritti cui era stata prescritta la metformina.
Solo il 3,7% dei pazienti con prediabete aveva ottenuto la prescrizione del farmaco e dopo aggiustamento per età, reddito e istruzione, la probabilità predetta era di quasi due volte superiore tra le donne e i pazienti obesi e più di 1,5 volte superiore tra quelli con due o più patologie concomitanti.
Una condizione di limitazione era dettata dai dati mancanti sugli interventi di stile di vita, sul possibile errore di classificazione del prediabete e sull'uso della metformina e sull'incapacità di definire i pazienti eleggibili, esattamente come indicati dalle linee guida dell'American Diabetes Association.
In conclusione, l’evidenza dimostrava che la metformina era raramente prescritta per la prevenzione del diabete negli adulti in età lavorativa. Tutto ciò non era, in effetti, chiaro tenuto conto dell'inclusione della raccomandazione della prescrizione del farmaco nelle linee guida nazionali per più di sei anni nell'approccio clinico del mondo reale per la prevenzione del diabete, della sua provata tollerabilità a lungo termine, della sicurezza e del costo-efficacia. Le linee guida dicono, infatti, che i medici possono considerare il trattamento con metformina nei pazienti con alterata tolleranza al glucosio, con irregolarità della glicemia a digiuno, o con un HbA1c tra il 5,7% sino al 6,4%.
Metformina, diabete e fibrillazione atriale
La fibrillazione atriale (FA), tachiaritmia molto comune nella pratica clinica, si associa con una grave morbilità e mortalità. I meccanismi alla sua base sono estremamente complessi e le attuali strategie per il trattamento e la prevenzione sono ancora subottimale. I fattori di rischio includono l’età, il sesso maschile, l'ipertensione, la malattia valvolare, l’insufficienza cardiaca congestizia e il diabete mellito. In particolare, vi sono anche evidenze che hanno suggerito che nella patogenesi della FA associata al diabete mellito possa essere coinvolta l'infiammazione. La metformina, agente anti-diabetico di prima linea più comunemente usato, ha già dimostrato di attenuare le risposte infiammatorie e lo stress ossidativo nei pazienti diabetici, indipendentemente dal suo effetto ipoglicemizzante. Inoltre, la FA ha dimostrato di aumentare lo stress ossidativo e d’indurre il rimodellamento strutturale nei miociti atriali, noto anche come miolisi, con degrado delle miofibrille e deposizione del glicogeno.
Shang-Hung Chang dell’University Chang Gung Memorial Hospital, Kweishan, Taiwan e collaboratori hanno voluto esaminare se la metformina potesse impedire la comparsa della fibrillazione atriale nei pazienti con diabete di tipo 2, analizzando una coorte dinamica sulla popolazione nazionale (Cardiovasc Diabetol. 2014;13 (123).
I ricercatori hanno, inoltre, studiato l'effetto della metformina sulla miolisi inducente la tachicardia e sullo stress ossidativo nelle cellule atriali.
La popolazione dello studio includeva da un sottoinsieme del database della Taiwan National Health Insurance Research Database 645.710 pazienti con diabete di tipo 2 che non utilizzavano altri farmaci anti-diabetici. Di questi pazienti chi usava la metformina era classificato nel gruppo degli utenti, mentre il restante in quello dei non-utenti. Era utilizzato il modello di rischio proporzionale in funzione del tempo di Cox per esaminare l'effetto della metformina sulla fibrillazione atriale e il suo stato di utilizzo era trattato come covariata dipendente dal tempo. Le cellule atriali HL-1 erano stimolate con o senza metformina. Di poi, la troponina e la miosina a catena pesante erano misurate come marcatori della miolisi.
Dopo tredici anni di follow-up, 9.983 pazienti sviluppavano FA con un tasso d’incidenza dello 1,5% (287 per 100.000 persone-anno). Dopo aggiustamento per le comorbilità e i farmaci, la metformina proteggeva indipendentemente i pazienti diabetici dalla nuova insorgenza di FA con un hazard ratio di 0,81 (95% intervallo di confidenza 0,76-0,86, p <0,0001). La metformina diminuiva anche significativamente l'entità della miolisi indotta dalla stimolazione e della produzione di specie reattive dell'ossigeno.
In conclusione, l'uso della metformina risultava associato a un ridotto rischio della fibrillazione atriale nei pazienti con diabete di tipo 2 che non stavano usando altri farmaci anti-diabetici, probabilmente attraverso l'attenuazione dello stress ossidativo e della miolisi delle cellule atriali inducenti la tachicardia.
Metformina, diabete e trombosi venosa profonda
La malattia vascolare del sistema venoso è anche abbastanza comune nei pazienti con diabete. Gli studi epidemiologici dimostrano, in effetti, un aumento del rischio sia della DVT (Deep Vein Thrombosis) e sia della PE (Pulmonary Embolism) tra i pazienti diabetici. La DVT provoca, peraltro, limitazioni frequenti delle attività quotidiane, mentre l’embolia polmonare può contribuire a una condizione di pericolo di vita.
Dai-Yin Lu del Taipei Veterans General Hospital, Taiwan e collaboratori, utilizzando un database a livello nazionale, hanno condotto uno studio non randomizzato di coorte appaiata per indagare la relazione tra la terapia con metformina e il successivo sviluppo di trombosi venosa profonda tra i pazienti con diabete di tipo 2, (BMC Cardiovascular Disorders 2014, 14: 187).
Gli Autori, sulla base delle segnalazioni precedenti sugli effetti della metformina sulla trombosi venosa in pazienti con diabete di tipo 2, ipotizzavano che il farmaco potesse ridurre lo sviluppo della complicanza.
S’identificava, quindi dal 1997 al 2003 un gruppo di studio composto di pazienti del database nazionale di assicurazione malattia con diabete di tipo 2 in trattamento con metformina. Si selezionava per il confronto anche una coorte di controllo senza metformina, abbinata per età, sesso, comorbidità e farmaci.
Nel corso di un periodo medio di follow-up di 3,74 anni, dei 14.945 pazienti (7.167 con metformina vs 7778 di controllo) sessanta (lo 0,40%) sviluppavano la TVP, di cui sedici della coorte con metformina (lo 0,21%) e quarantaquattro (lo 0,56%) del gruppo di controllo. I soggetti con metformina sperimentavano il cambiamento di riduzione del rischio di sviluppo della TV di 0,427 volte (intervallo di confidenza 95%= 0,240-0,758; P = 0,004), indipendentemente dall'età, dal sesso e dalle comorbidità.
L’analisi Kaplan-Meier rivelava anche che la terapia con metformina si associava a una minore insorgenza di TVP (log-rank test, P = 0,001).
In conclusione, la metformina poteva avere effetto protettivo sulla TVP nei pazienti diabetici di tipo 2.
Metformina, diabete e malattie neurodegenerative
Il diabete è epidemiologicamente sempre più diffuso e si presenta spesso con una vasta gamma di complicanze sistemiche tra cui la DPN (diabetic peripheral neuropathy) che si verifica nel 50% dei casi e provoca disfunzioni sensoriali, motorie e / o autonomomiche. Diversi meccanismi patogenetici contribuiscono alla gravità della DPN e comprendono la microangiopatia, lo stress ossidativo, il flusso dei polioli, la disfunzione mitocondriale, la carenza d’insulina e dei prodotti terminali della glicosilazione avanzata e l’attivazione legante del loro recettore. Il decorso e la gravità della DPN sono ulteriormente colpiti da una vasta gamma di condizioni di comorbidità. Con il diabete può anche coesistere un’ipovitaminosi B12 (cobalamina [Cbl]). Peraltro, sebbene possa essere associata più classicamente con la degenerazione subacuta combinata, la malattia può presentarsi con un’esclusiva neuropatia periferica, in genere di tipo assonale, basata su effetti elettrofisiologici e patologici. Un cumulo di evidenze ha suggerito che, piuttosto che la Cbl nel siero di per sé, i metaboliti associati alla Cbl, il MMA (methylmalonic acid) e l’Hcy (homocysteine), sono gli indicatori più sensibili e il MMA più specifico della carenza vitaminica sintomatica precoce,.
La metformina è da qualche tempo segnalata come causa farmacologica della carenza della Cbl con meccanismi controversi, tra cui l’inibizione competitiva o l’inattivazione dell’assorbimento per alterazioni intrinseche intestinali, come la flora batterica gastrointestinale o la struttura morfologica ileale, e l'interazione con il cubulin endocytic receptor. Le biguanidi, peraltro, altererebbero nell’ileo l’attività di membrana calcio-dipendente e, quindi, l'assorbimento del complesso fattore intrinseco della Cbl.
El-Mir MY dell’Universidad de Salamanca, Spain e collaboratori, sulla base del coinvolgimento del danno ossidativo nella patogenesi della neuropatia diabetica e delle malattie neurodegenerative, hanno voluto segnalare l'effetto neuroprotettivo diretto della metformina in un modello di morte cellulare indotta dall’etoposide (Journal of Molecular Neuroscience MN [2008, 34 (1):77-87).
Tutto ciò anche in ragione delle evidenze che suggerivano che la metformina preveniva la morte da stress ossidativo in linee cellulari non neuronali comunemente presente nella patogenesi della neuropatia diabetica e delle malattie neurodegenerative. L'esposizione dei neuroni primari intatti a questo insulto citotossico induceva, invero, la PTP (permeability transition pore) di apertura, la dissipazione del potenziale di membrana mitocondriale (DeltaPsim), il rilascio del citocromo C e la consequenziale morte. Ancora più importante, la metformina, unitamente alla CsA (cyclosporin A), classico fattore inibitore del PTP, attenuava fortemente l'attivazione di questa cascata apoptotica. Inoltre, l'antiossidante generale N-acetil-L: -cisteina impediva anche la morte neuronale promossa dall’etoposide. In aggiunta, la metformina dimostrava di ritardare l'apertura del PTP sensibile alla CsA nei neuroni permeabilizzati, come da innescamento di un sovraccarico di calcio, probabilmente attraverso il suo lieve effetto inibitorio sulla complessa catena respiratoria I.
Gli Autori concludevano, quindi, che:
(1) la morte neuronale indotta dall’etoposide era parzialmente attribuibile all’apertura del PTP e all'interruzione dei DeltaPsim, in collaborazione con l'emergere dello stress ossidativo,
(2) la metformina inibiva questo impegno di apertura del PTP che portava alla morte.
Si proponeva, pertanto, che metformina, oltre al suo ruolo ipoglicemizzante, poteva anche funzionare come un nuovo strumento terapeutico per le malattie neurodegenerative associate al diabete.
D’altro canto, l’American Diabetes Association e l’Associazione Europea per lo Studio del Diabete hanno già raccomandato la metformina come terapia medica iniziale del diabete tipo 2.
Daryl J. Wile dell’University of Calgary, Alberta, Canada e collaboratori, nell'intento di chiarire il rapporto tra metformina, livelli di Cbl, Hcy e MMA e la gravità della neuropatia periferica nei diabetici, hanno eseguito uno studio prospettico caso-controllo (Diabetes Care 33:156–161, 2010).
Gli Autori ipotizzavano che l'esposizione alla metformina avrebbe potuto produrre livelli più bassi di Cbl, innalzare quelli di Hcy e MMA e, quindi, determinare una neuropatia periferica più grave.
Confrontavano, quindi, cinquantanove diabetici che avevano ricevuto per più di sei mesi la metformina con sessantatré senza il farmaco.
Per questo confronto si utilizzavano il Toronto Clinical Scoring System e il Neuropathy Impairment Score da una parte e dall’altra la Cbl sierica, la Hcy e il MMA a digiuno e le misure elettrofisiologiche con studi sulla conduzione nervosa.
I pazienti trattati con metformina mostravano riduzione dei livelli di Cbl ed elevati valori a digiuno dello MMA e della Hcy. Le misure cliniche ed elettrofisiologiche identificavano anche una neuropatia periferica più grave e la dose cumulativa di metformina correlava fortemente con le differenze tra i gruppi clinici e paraclinici.
In conclusione, L'esposizione alla metformina poteva essere una causa iatrogena di aggravamento della neuropatia periferica nei pazienti con diabete di tipo 2.
Metformina, diabete e glaucoma
Julia E Richards dell’Univ of Michigan-Kellogg Eye Ctr e collaboratori, in considerazione del ritardo o riduzione di alcuni rischi d’invecchiamento documentati con i farmaci dotati di restrizione calorica per loro effetti neuroprotettivi, hanno voluto testare l'ipotesi che la metformina potesse ridurre il rischio di OAG (open-angle glaucoma) tardivo (Invest Ophthalmol Vis Sci 2014; 55: E-Abstract 1668).
Gli Autori hanno, così, analizzato nove anni di dati longitudinali da una grande banca dati degli Stati Uniti sulla salute (2001-2009). I diabetici di quaranta anni e oltre, senza preesistente OAG, erano monitorati basandosi sul predittore chiave della metformina. Un modello di rischio proporzionale di Cox testava l'effetto del farmaco sulla pericolosità di sviluppo dell’OAG, corretto per i fattori socio-demografici, per il controllo glicemico (livello di HbA1c), per altri farmaci antidiabetici e oculari e per le condizioni sistemiche.
Dei 150.016 diabetici, 5.893 (il 3,9%) sviluppavano l’OAG. L'utilizzo di più di 1.110 grammi cumulativi di metformina in due anni si associava a una riduzione del 25% del rischio relativo di sviluppare la malattia oculare (HR = 0.75; IC 95%= 0,59-, 95; p = 0.017) rispetto al non uso. Ogni aumento di un grammo di metformina si associava a una riduzione del rischio di 0,01% (p = 0.001), quindi, in maniera dose-dipendente. In tal modo, chiunque avesse ricevuto una dose normale del farmaco (2 grammi/die) avrebbe dimostrato in due anni una riduzione del 13% del rischio assoluto di OAG, rispetto a chi non lo avesse utilizzato. Una volta stratificato per il rischio basale di OAG e per il livello di HbA1c, la maggiore riduzione del rischio assoluto indotto dalla metformina si dimostrava nei casi con il più alto rischio di base e con i massimi livelli di HbA1c. Sebbene i livelli di HbA1c fossero associati a un aumentato rischio di OAG (HR = 1.08; IC 95%= 1,03-1,13; p = 0,003), gli altri farmaci ipoglicemizzanti non lo riducevano. Peraltro, la riduzione del rischio di OAG in risposta alla metformina si verificava quando erano presi in considerazione i livelli di HbA1c.
Metformina, diabete e insufficienza renale cronica
La metformina è stata tradizionalmente controindicata nella malattia renale cronica (CKD), anche se le linee guida degli ultimi anni hanno limitato tale condizione permettendone l’uso in caso di velocità di filtrazione glomerulare (GFR) maggiore ai 30 ml / min. Il problema principale era costituito dal rischio dell’acidosi lattica (LA). Pur tuttavia, l'evidenza epidemiologica ha suggerito che questa preoccupazione era sproporzionata. L'acidosi lattica, in effetti, è una complicanza rara del diabete di tipo 2 (DM2) e la sua incidenza di 6 / 100.000 pazienti-anno e il suo rischio non aumenta nei pazienti trattati con metformina. Peraltro, la metformina possiede un certo numero di effetti clinici indipendenti dalla riduzione della glicemia, compresa la perdita di peso e i benefici cardiovascolari. Questi dati sono, di certo, vantaggiosi per i pazienti per cui il rischio di morte e di malattia cardiovascolare si riduce di circa un terzo nei pazienti non CKD. Pur tuttavia, poiché l’intossicazione di metformina provoca indubbiamente la LA e poiché il farmaco è escreto per via renale, il suo dosaggio inadeguato aumenta, in verità, il rischio della complicanza. Viene, comunque, suggerito da più parti che l'introduzione della terapia con metformina nelle fasi più avanzate della malattia renale cronica può portare benefici terapeutici che, in effetti, tendono a superare i possibili rischi.
Per quanto su esposto, Claire Briet dell’Université René Descartes, Paris, France e collaboratori hanno compiuto uno studio sulla distribuzione della metformina negli eritrociti in una popolazione con un’ampia gamma di eGFR (Clin Kidney J (2012) 5: 65–67).
Gli Autori traevano spunto della loro ricerca dalle raccomandazioni cliniche sull'uso del farmaco nei diabetici di tipo 2 con gravità variabile di CKD (chronic kidney disease). Negli studi di settore la soglia di 20 mmol / L (2,8 mg / L) costituiva, invero, un preliminare limite superiore terapeutico. Tuttavia, questo dato poteva essere messo in discussione per diversi motivi per cui le sue concentrazioni negli eritrociti apparivano una migliore stima del rischio di accumulo. In effetti, la metformina, con un’emivita più lunga negli eritrociti di quella nel plasma (23.4 + 1.9 contro 2.7 + 1,2 h), permetteva un'interpretazione di un singolo punto temporale di concentrazione meno critica se il tempo dell'ultima assunzione non era noto.
Gli Autori esaminavano, così, sistematicamente tutti i test sulla metformina negli eritrociti, registrati nel loro centro medico universitario di laboratorio nel 2008 e 2009.
I valori medi dei 240 pazienti selezionati, maschi nel 64%, erano: età sessantacinque anni (38-88), indice di massa corporea 32 (20-77) kg / m2, emoglobina glicata media 8,1% (5,4-15,9), GFR 47 mL / min / 1,73m2 (6,8-120), dose giornaliera di metformina 2000 mg (500-4000), livello del farmaco 1,06 mg / L (0,12-3,11).
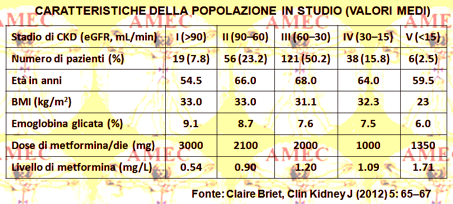
Circa due terzi dei pazienti (il 68,5%) avevano un eGFR <60 ml / min / 1,73m2. Rispetto ai pazienti al primo stadio, quelli con eGFR inferiori avevano una maggiore età, un valore di emoglobina glicata inferiore, una dose più bassa giornaliera di metformina e suoi livelli più elevati. Tuttavia, lo stadio cinque era costituito da un gruppo specifico di pazienti. Difatti, erano non obesi e non in sovrappeso, con un normale valore di emoglobina glicata e con un’età media di 59,5 anni nella media, registrata per gli stadi da due a quattro (> 64.0) e 1 (54.5). Infine, la riduzione della dose media di metformina era inferiore nei pazienti dello stadio cinque, rispetto a quelli del quattro.
Il 95° percentile era 2.86 mg / L e nessuno dei pazienti dello stadio uno aveva livelli di metformina sopra questo valore. Negli stadi da due a quattro la percentuale di pazienti con livelli di metformina superiore al 95° percentile era relativamente piccola e andavano da 1,7 a 10,5%. La percentuale era più alta nel piccolo gruppo di pazienti dello stadio cinque. Considerando i valori individuali, per i pazienti degli stadi da due a cinque la distribuzione dei livelli di metformina non sembrava dipendere dall’eGFR.
Ai fini comparativi, il limite superiore del gruppo di riferimento senza insufficienza renale era di 1,6 mg / L e il valore massimo di metformina mai riportato in letteratura era 61 mg / L.
In conclusione, applicando la riduzione della dose di metformina praticamente in uso presso il loro centro nei pazienti con basso eGFR, i valori elevati di metformina erano rari e non s'incontravano vere condizioni di un suo accumulo.
Inzucchi SE dell’Yale University School of Medicine, New Haven, Connecticut e collaboratori, rilevando che la metformina, ampiamente considerata come la migliore opzione farmacologica iniziale per le concentrazioni di glucosio più basse nei pazienti con diabete di tipo 2, era, tuttavia, controindicata nella funzione renale compromessa a causa della possibile di acidosi lattica, hanno voluto compiere una revisione per meglio chiarire quest’aspetto (JAMA. 2014 Dec 24-31;312 (24):2668-75).
Gli Autori hanno, così, eseguito una ricerca bibliografica dal 1950 al giugno 2014, selezionando sessantacinque studi di farmacocinetica, metabolici, con ampia casistica, retrospettivi, meta-analisi e una sperimentazione clinica.
Gli Autori consideravano che la metformina, pur drenata per via renale, avrebbe generalmente mantenuto i suoi livelli entro le concentrazioni terapeutiche e che i livelli del lattato non sarebbero aumentati sostanzialmente nei pazienti con lieve o moderata malattia renale cronica (velocità di filtrazione glomerulare stimata, 30-60 ml / min per 1,73 m2). L'incidenza complessiva fra gli studi dell’acidosi lattica nei consumatori della metformina variava da circa tre a dieci per 100.000 persone-anno e generalmente era indistinguibile dal tasso di fondo della popolazione globale diabetica. I dati suggerivano nei pazienti trattati con metformina con malattia renale cronica un aumento limitato del rischio dell’acidosi lattica. Peraltro, non vi erano studi randomizzati controllati, condotti per testare la sicurezza del farmaco in condizioni di funzione renale significativamente compromessa. Gli studi sulla popolazione dimostravano, peraltro, che la metformina poteva essere prescritta anche in contrasto con le linee guida prevalenti, suggerendo che nella maggior parte dei casi non si associava un aumento dei tassi di acidosi lattica. Inoltre, studi osservazionali indicavano un potenziale beneficio dalla metformina sugli esiti macrovascolari, anche nei pazienti con controindicazioni renali prevalenti per il suo utilizzo.
Pertanto, gli Autori concludevano che le evidenze disponibili supportavano l'espansione prudente dell’uso della metformina nei pazienti con lieve o moderata malattia renale cronica, come definito dalla velocità di filtrazione glomerulare stimata, con le opportune riduzioni di dosaggio e con l’attento follow-up della funzione renale.
Metformina, diabete, vitamina B12 e demenza
Molti studi hanno dimostrano che le persone con diabete di tipo 2 sono a un maggior rischio di sviluppare la demenza rispetto alla popolazione generale. Per altro verso, sin dagli anni 1970 l’uso della metformina in alcuni pazienti con diabete di tipo 2 è stato associato a un deterioramento cognitivo che può essere attenuato con la somministrazione della vitamina B12 e con la supplementazione di calcio.
In effetti, la VB12, o cobalamina, vitamina solubile in acqua, per il suo particolare ruolo nella sintesi del DNA, è essenziale per la funzione normale del sistema nervoso e per l’eritropoiesi. Essa è sostanziale per tre processi enzimatici che comprendono la conversione di:
a) omocisteina in metionina,
b) acido metilmalonico in succinilcoenzima A,
c) 5 metiltetraidrofolato in tetraidrofolato.
La sua carenza suole manifestarsi con rilievi ematologici, come l’anemia macrocitica (megaloblastica) e, nei casi avanzati, come la pancitopenia. Pur tuttavia, i segni e i sintomi clinici sono divergenti e vanno oltre il sistema ematologico. Comunemente colpito dal deficit è il sistema nervoso con diversi gradi di neuropatia sensoriale sino au casi gravi con progressione verso la sclerosi combinata del midollo spinale. Da un punto di vista clinico, l'identificazione e la prevenzione della carenza della VB12 legate alla metformina costituiscono la chiave per fornire la migliore assistenza ai pazienti diabetici.
In effetti, fino al 30% dei pazienti trattati con il farmaco può essere carente della B12 a causa di un’interazione tra esso stesso e un recettore nell'ileo distale con la consequenziale inibizione dell’assorbimento della sostanza. Questo dato non deve, però, dissuadere dall’uso dell’antidiabetico che deve rimanere il farmaco di prima linea perché molto efficace e capace di ridurre il rischio cardiovascolare nei pazienti con diabete. I medici e i pazienti, pertanto, invece di preoccuparsi, dovrebbero monitorare e correggere i livelli della vitamina B12, quando evidenziati insufficienti.
Sarebbe, quindi buona norma nel diabete mirare a mantenere buoni, piuttosto che adeguati, i livelli sierici della vitamina B12. Questi dovrebbero essere superiori a 300 pmol / L per ridurre più tardi nella vita il rischio del declino cognitivo.
Inoltre, a causa del malassorbimento i pazienti che assumono la metformina non possono aspettarsi quantità adeguate di vitamina B12 da una semplice dieta equilibrata. I medici, quindi, dovrebbero anche riconoscere e valutare gli altri fattori di rischio dell’ipovitaminosi, quali una dieta strettamente vegetariana, la chirurgia intestinale, le complicazioni che interessano le cellule parietali dello stomaco o dell’ileo distale, o l'uso concomitante di altri farmaci che deprimono l'acidità gastrica.
Infine, è bene sorvegliare attentamente i livelli della vitamina B12 nei pazienti in trattamento con metformina, soprattutto se continuato per più di tre anni, almeno annualmente e quando compaiono alcuni altri indicatori della possibile ipovitaminosi, come la neuropatia, le disfunzioni cognitive e / o l’aumento del volume corpuscolare medio delle emazie.
I casi dovrebbero essere convalidati, quindi, con la valutazione dei livelli plasmatici della B12 e con una misurazione dell’acido metilmalonico, come indice della carenza di vitaminica.
Peraltro, poiché il diabete stesso è anche un fattore di rischio indipendente per la demenza, bisognerebbero considerare lo studio della cognizione in tutti i pazienti di età superiore ai cinquanta anni che fanno uso del farmaco, soprattutto alla presenza di altri fattori di rischio.
Eileen M. Moore dell’University of Melbourne – Australia e collaboratori hanno voluto proprio studiare le associazioni tra metformina, livelli sierici di vitamina B12, integratori di calcio e il deterioramento cognitivo nei pazienti con diabete (Diabetes Care September 5, 2013).
Gli Autori hanno, così, reclutato dagli studi sull’invecchiamento PRIME (Primary Research in Memory), AIBL (Australian Imaging, Biomarkers and Lifestyle) e dalla regione del sud-est dell'Australia Barwon 480 pazienti con malattia di Alzheimer (AD), 187 con decadimento cognitivo lieve e 687 cognitivamente indenni. Si escludevano i pazienti con ictus o con malattie neurodegenerative diverse dall’AD. Le analisi dei sottogruppi erano effettuate per i partecipanti che avevano avuto il diabete di tipo 2 (n = 104) o la ridotta tolleranza al glucosio (n = 22).
I partecipanti con diabete (n = 126) dimostravano performance cognitive peggiori rispetto a quelli senza la malattia (n = 1.228; odds ratio aggiustato 1,51 [IC 95%= 1,03-2,21]). Tra i partecipanti con il diabete le prestazioni cognitive peggiori erano associate con l'uso della metformina (2,23 [1,05-4,75]). Dopo aggiustamento per età, sesso, livello d’istruzione, storia di depressione, vitamina B12 sierica e uso di metformina, i partecipanti con diabete che stavano assumendo supplementi di calcio dimostravano prestazioni cognitive migliori (0,41 [0,19-0,92]).
In conclusione, l’uso della metformina risultava associato a prestazioni cognitive compromesse. La vitamina B12 e i calcio integratori potevano alleviare l’ipovitaminosi indotta dal farmaco, migliorando gli esiti cognitivi.
A tale riguardo, Rachel Whitmer della Kaiser Permanente in Oakland, California e collaboratori hanno presentato i risultati di un loro studio (Oral Presentation: O1-05-05. Presented July 15, 2013 a Boston all’Alzheimer's Association International Conference (AAIC).
Gli scienziati tra il 1999 e il 2001 hanno condotto una ricerca retrospettiva preliminare di cinque anni sulla popolazione, esaminando i dati su 14,891 diabetici di età compresa tra i cinquantacinque anni o più con iniziale prescrizione di un ipoglicemizzante orale, metformina o sulfoniluree (SU) o tiazolidinedioni (TZD) e insulina.
Nel corso dello studio il 9.9% dei partecipanti osservati otteneva anche la diagnosi di demenza senza differenziazione tra il morbo di Alzheimer e le altre forme, la cui incidenza nei casi con assunzione della metformina era nettamente inferiore a quella di chi assumeva altri farmaci per il diabete. In particolare, la demenza si rilevava nel 9,5% dei 8.528 pazienti trattati con metformina, nel 19,9% dei 3.383 con una sulfonilurea, nel 9,8% dei 2.095 con TZD e nell’11,1% dei 905 con insulina. Nel corso dello studio, dopo aggiustamento per una serie di fattori di rischio, tra cui l'età, la razza, il controllo della glicemia, la durata del diabete e l'istruzione, si rilevava nel gruppo metformina una riduzione del rischio a cinque anni inferiore del 23% per la demenza, rispetto ai pazienti che avevano iniziato un tiazolidinedione (TZD) come il rosiglitazone (avandia). Il gruppo con metformina dimostrava anche un rischio inferiore del 20% per ogni demenza, rispetto a quelli con una sulfonilurea, come la gliburide. Tra i pazienti con una durata del diabete inferiore ai cinque anni, gli utilizzatori della metformina avevano, inoltre, un rischio di demenza inferiore del 40%, rispetto a quelli con sulfoniluree. Tra quelli con una durata del diabete di almeno dieci anni, il rischio per il gruppo con metformina era anche inferiore del 19%. In altri termini, nei diabetici con iniziale terapia con metformina si rilevava una riduzione del rischio di demenza di cinque anni, rispetto a quelli con altre terapie.
Più particolarmente, nei modelli multivariati con aggiustamento per età, razza, educazione e la durata del diabete, la metformina si associava a un hazard ratio (HR) per qualsiasi demenza di 0,77, rispetto a un TZD. Né le sulfoniluree né l’insulina si associavano a una significativa riduzione del rischio. Con l’aggiunta del controllo glicemico (HbA1c) al modello, la metformina rimaneva significativamente migliore (HR, 0.84) per la protezione contro la demenza, mentre gli altri agenti non erano significativamente migliori di un TZD.
Allo stesso modo, in un modello con la sulfoniluree come referente, la metformina si dimostrava significativamente migliore, con un HR aggiustato di 0,79 e di 0,80 nei modelli senza e con HbA1c, rispettivamente.
L'analisi degli effetti sui sottotipi della demenza dimostrava anche un significativo beneficio con la metformina vs la sulfonilurea per la protezione contro la malattia di Alzheimer (HR, 0,70) e la demenza vascolare (HR, 0,75).
Gli Autori facevano, infine, notare che la stima dei diabetici del tipo 2 si quantificava tra il 12 e il 25% dopo i sessantacinque anni di età per cui i loro dati indicavano un aumento circa del 50% del rischio di demenza, rispetto alle persone di pari età senza la malattia.
Lo studio era descritto osservazionale e di popolazione, progettato, quindi, per dimostrare una causa e un effetto. Esso riusciva a trovare un’associazione tra la metformina e il ridotto rischio di demenza, fornendo l’evidenza preliminare che il farmaco poteva avere benefici per la salute del cervello. Peraltro, numerosi lavori avevano indicato come l'insulina, e in particolare l'insulino-resistenza, potessero svolgere un ruolo nella malattia di Alzheimer. A tale riguardo, poi, alcune evidenze su studi sperimentali sugli animali e su colture cellulari avevano già teorizzato un ruolo della metformina sullo sviluppo di nuove cellule cerebrali, come fattore neurogenetico. La ricerca sugli animali aveva, inoltre, suggerito che il farmaco poteva contribuire alla creazione di nuove cellule cerebrali, migliorando la memoria spaziale e che poteva agire riducendo l’infiammazione.
Rima Obeid dell’University Hospital of the Saarland, Homburg, Germany ha voluto, per sua parte, mettere in discussione il verdetto di colpevolezza della metformina come causa della carenza della vitamina B12, a suo giudizio senza prove sufficienti (Diabetes Care February 2014 vol. 37 no. 2 e22-e23).
L’Autrice affermava che la responsabilità della metformina sulla carenza della vitamina B12 (B12) era, invero senza prove certe nella letteratura medica, diventata un mito tradizionale.
In effetti, la possibilità di misurare l’olotranscobalamina (HoloTc), come frazione attiva della vitamina e il MMA (methylmalonic acid), suo marcatore metabolico, ha cambiato negli ultimi anni la pratica della diagnosi dell’ipovitaminosi B12. Difatti, ne è conseguito che non tutti i bassi valori plasmatici di B12 corrisponderebbero a un deficit e così pure non tutti quelli alti a un’autosufficienza. In effetti, quando la B12 è interiorizzata ed è in grado di mantenere le attività enzimatiche intercellulari dipendenti da essa (la metionina sintasi e metilmalonil-CoA mutasi), l’omocisteina plasmatica totale (omocisteina totale) e il MMA rimangono nel range di riferimento. Questa rivoluzione nella diagnosi della carenza della vitamina B12 ha fornito, quindi, prove convincenti che la metformina non è così dannosa come vuole la sua reputazione.
Nel NHANES (National Health and Nutrition Examination Survey), che comprendeva 1.621 pazienti con diabete, di cui 575 con assunzione della metformina, la B12 sierica era più bassa (media geometrica 318 vs. 387 pmol / L, rispettivamente) e il tHcy plasmatico era leggermente inferiore nei pazienti che assumevano la metformina (9,8 vs. 10,4 mmol / L; p = 0,1015), rispetto ai non utilizzatori del farmaco. Questo rapporto del NHANES aveva il vantaggio di minimizzare l'effetto del folato sulla tHcy plasmatica perché condotto dopo l’inizio della fortificazione con acido folico negli Stati Uniti (media siero folato ~ 40 nmol / L). Pertanto, dopo questa fortificazione la vitamina B12 è diventata un fattore determinante del tHcy plasmatico. Pur tuttavia, nonostante l’evidente effetto della metformina sulla riduzione della B12 plasmatica, le concentrazioni di tHcy non erano elevate, come prevedibile. Allo stesso modo, uno studio di follow-up ha dimostrato che l'uso di 850 mg / metformina/die (rispetto all'insulina) su una media di 3,4 anni in 390 pazienti con diabete di tipo 2 abbassava la B12 plasmatica, ma l’omocisteina totale non era significativamente superiore rispetto al gruppo con insulina. Vi sono state, peraltro, ulteriori prove che i pazienti in cura con metformina avevano più bassi livelli di B12 sierica e di olotranscobalamina, ma markers metabolici simili, come il tHcy, il MMA e l'indice di metilazione (S-adenosilmetionina / S-adenosilomocisteina). Pertanto, in un gran numero di pazienti trattati con metformina le reazioni dipendenti dalla B12 sarebbero ben funzionanti, nonostante i bassi valori sierici di B12. Questi stessi da soli e senza perturbazioni dei marcatori metabolici non hanno, infatti, alcun valore diagnostico. Di converso, la maggiore quota di B12 nel siero nei pazienti non trattati con metformina potrebbe dare l'impressione sbagliata che la carenza di vitamina B12 sia meno comune. La metformina è stata anche imputata di ridurre l'assorbimento della B12 in uno studio che l’ha utilizzata insieme con il calcio, senza il controllo di un potenziale effetto indipendente del calcio sull'assorbimento della vitamina. Tutte le prove disponibili hanno indicato, peraltro, che la terapia con metformina, abbassando la B12 plasmatica e se non associata a un aumento dei metaboliti, significherebbe un suo maggiore assorbimento cellulare. Sotto tale punto di vista, è utile uno studio che ha dimostrato che gli animali trattati con metformina accumulano più B12 nel fegato, dando spiegazione dell’abbassamento dei suoi livelli plasmatici.
Rima Obeid, considerando nel loro insieme quanto riportato, affermava che non ravvedeva prove sui livelli patologici più comuni dei marker biochimici della B12 nei pazienti trattati con metformina rispetto a quelli senza il farmaco, nonostante l'abbassamento della vitamina nel siero o plasma.
Per loro conto, Mitra Niafar della Tabriz University in Medical Sciences, Tabriz, Iran e collaboratori, hanno voluto valutare la carenza di vitamina B12 (VB12) in diabetici di tipo 2 (DM-2) in trattamento con metformina o con altri agenti ipoglicemizzanti (Eur Res J 2015;1 (1):1-7. Published Online 2015 March 4)
Gli Autori hanno, quindi, studiato 400 pazienti con DM-2 divisi in due bracci (N = 200 / gruppo):
- quelli trattati con metformina (MET) per almeno sei mesi,
- quelli che ricevevano ipoglicemizzanti diversi dalla metformina (OHA).
Erano, peraltro, misurate le concentrazioni VB12 del siero e i dati erano analizzati utilizzando due campioni t-test per i dati numerici e il chi-quadro con analisi di regressione logistica per i dati categorici. I valori numerici erano espressi come media ± deviazione standard. Le ipotesi nulle erano respinte a valori di P <0,05.
Definita la carenza biochimica VB12 come inferiore a 148 pmol / L, essa era riscontrata in 29/200 (14,5%) del gruppo MET, mentre in 4/200 (2%) di quello OHA (P <0.001). Allo stesso modo, la possibile carenza di VB12, definita da concentrazioni sieriche inferiori a 185 pmol / L, si rilevava in 39 (19,2%) del gruppo MET e in 12 (6%) di quello OHA (p <0.001). C'era, poi, una correlazione positiva tra il livello basso di VB12 e la somministrazione di metformina (R2 = 0,26, p <0,001).
In conclusione, i pazienti con DM-2 trattati con metformina avevano livelli di VB12 inferiori a quelli in cura con altri farmaci ipoglicemizzanti. Pertanto, la relazione tra la carenza vitaminica e la terapia con metformina indicava la necessità di una misurazione periodica dei livelli sierici dellaVB12 in questi pazienti.











.png)





